
【題目】下列圖示與對應的敘述相符的是
A.如圖表示某放熱反應分別在有、無催化劑的反應過程
B.如圖表示2NO2(g)![]() N2O4(g) ΔH<0的v逆 隨時間變化曲線,t1時刻改變的條件是降低溫度
N2O4(g) ΔH<0的v逆 隨時間變化曲線,t1時刻改變的條件是降低溫度
C.如圖表示反應N2(g)+3H2(g)![]() 2NH3(g) ΔH<0的平衡常數K隨壓強的變化
2NH3(g) ΔH<0的平衡常數K隨壓強的變化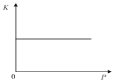
D.如圖表示電解精煉銅過程中陽極質量隨時間的變化
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知可逆反應A+aB![]() C+2D(a為化學計量數),其中B,C,D為氣態物質。反應過程中,當其他條件不變時,C的體積百分含量()與溫度(T)和壓強(p)的關系如圖1、2所示。下列不正確的是( )
C+2D(a為化學計量數),其中B,C,D為氣態物質。反應過程中,當其他條件不變時,C的體積百分含量()與溫度(T)和壓強(p)的關系如圖1、2所示。下列不正確的是( )
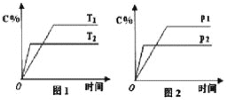
A. T2 >T1,P2 >P1
B. 該反應的正反應為放熱反應
C. 若a=2,則A為液態或固態物質
D. 增加B的物質的量,該反應的ΔH絕對值增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2是一種重要的無機功能材料,可由MnSO4和NaClO3溶液反應制得,反應原理為: MnSO4+ NaClO3+ H2O![]() Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),則關于此反應的敘述不正確的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),則關于此反應的敘述不正確的是
A.NaClO3中Cl的化合價為+5
B.每生成8.7 g氧化產物,反應中轉移的電子數約為0.2×6.02×1023
C.NaClO3的氧化性強于MnO2的氧化性
D.該反應右邊方框內的產物是NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】As2O3(砒霜)是兩性氧化物(分子結構如圖所示),溶于鹽酸生成AsCl3,AsCl3用LiAlH4還原生成AlH3。下列說法正確的是( )
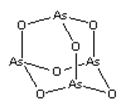
A.As2O3 分子中As原子的雜化方式為sp2
B.LiAlH4為共價化合物
C.AsCl3空間構型為平面正三角形
D.AlH3分子鍵角大于109.5°
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知還原性:![]() 某無色溶液中只可能含有
某無色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分離子,進行下列實驗:通過實驗得出的結論正確的是
中的部分離子,進行下列實驗:通過實驗得出的結論正確的是![]()
實驗編號 | 操作 | 現象 |
| 取10mL溶液,先加入稍過量的氯水,后加入苯并充分振蕩、靜置 | 生成無色氣體、上層為紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入過量的NaOH溶液并加熱 | 產生448L氣體 |
A.實驗![]() 中若通入過量的
中若通入過量的![]() ,則先后氧化了
,則先后氧化了![]() 、
、![]()
B.上述3個實驗不能確定是否一定含有![]() ,判斷方法:在溶液中加硝酸銀,再加硝酸,若有沉淀生成,則證明有
,判斷方法:在溶液中加硝酸銀,再加硝酸,若有沉淀生成,則證明有![]()
C.判斷溶液中是否含有鉀離子,不需要通過焰色反應來檢驗
D.實驗![]() 能夠確定溶液中不含有
能夠確定溶液中不含有![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的Cl2通入一定濃度的苛性鉀溶液中,兩者恰好完全反應(已知反應過程放熱),生成物中有三種含氯元素的離子,其中ClO-和ClO![]() 兩種離子的物質的量(n)與反應時間(t)的變化示意圖如圖所示。下列說法不正確的是
兩種離子的物質的量(n)與反應時間(t)的變化示意圖如圖所示。下列說法不正確的是
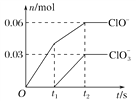
A. 反應中轉移電子的物質的量是0.21 mol
B. ClO![]() 的生成可能是由于溫度升高引起的
的生成可能是由于溫度升高引起的
C. 標準狀況下有3.36 L氯氣參加反應
D. 苛性鉀溶液中KOH的物質的量為0.2 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LiCoO2(鈷酸鋰)是鋰離子電池的正極材料。以某海水為原料制備鈷酸鋰的一種流程如下:
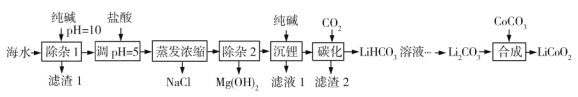
已知如下信息:
①該海水中含濃度較大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸鋰的溶解度與溫度關系如圖所示:

③常溫下,幾種難溶物質的溶度積數據如下:
物質 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
請回答下列問題:
(1)LiCoO2中鈷的化合價為________。濾渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化學式)。
(2)調節pH=5的目的是__________。
(3)“沉鋰”包括過濾、洗滌等,宜用_________(填“熱水”或“冷水”)洗滌Li2CO3。加入純堿的量與鋰回收率的關系如表所示:
序號 |
| 沉淀質量/g | 碳酸鋰含量/% | 鋰回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
從生產成本考慮,宜選擇_______(填序號)方案投料。
(4)“除雜2”中調pH=13時c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高溫條件,放出一種能使澄清石灰水變渾濁的氣體。寫出“合成”發生反應的化學方程式________。
(6)在“合成”中制備1 mol LiCoO2轉移電子的物質的量為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以二氧化碳和氫氣為原料制取乙醇的反應為2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某壓強下的密閉容器中,按CO2和H2的物質的量比為1:3投料,不同溫度下平衡體系中各物質的物質的量百分數(y%)隨溫度變化如圖所示。下列說法正確的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某壓強下的密閉容器中,按CO2和H2的物質的量比為1:3投料,不同溫度下平衡體系中各物質的物質的量百分數(y%)隨溫度變化如圖所示。下列說法正確的是
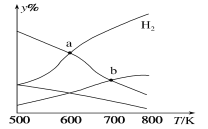
A.a點的平衡常數小于b點
B.b點,v正(CO2)=v逆(H2O)
C.a點,H2和H2O物質的量相等
D.其他條件恒定,充入更多H2,v(CO2)不變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com