
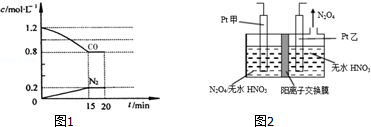
分析 (1)①根據v=$\frac{△c}{△t}$,轉化率=$\frac{轉化量}{起始量}$×100%進行計算;
②若改變反應條件,導致CO濃度減小,可以采用改變溫度或容器容積的方法;
③根據平衡時濃度,結合平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積計算其平衡常數,再根據濃度商與化學平衡常數相對大小判斷平衡移動方向;
(2)2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-a kJ•mol-1①
2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1②
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1③
由蓋斯定律可知①-②+2×③得 4CO(g)+2NO2(g)=N2(g)+4CO2(g);
(3)由圖可知,乙電極上有四氧化二氮生成,發生還原反應,則乙為陰極,故甲為陽極,N2O4在陽極失去電子,在硝酸條件下生成N2O5,根據電荷守恒可知,還有氫離子生成.
解答 解:①0~15min△C(N2)=0.2mol/L,故0~15min N2的平均速率v(N2)=$\frac{0.2mol/L}{15min}$≈0.013mol/(L•min),
△C(N2)=0.2mol/L,則△C(NO)=2△C(N2)=0.2×2=0.4mol/L,△n(NO)=0.4mol/L×2L=0.8mol,故NO的轉化率=$\frac{0.8}{2}$×100%=40%;
故答案為:0.013mol/(L•min);40%;
②a.縮小容器體積,壓強增大,平衡向正反應方向移動,但CO濃度增大,故a錯誤;
b.增加CO的量,平衡向正反應方向移動,但CO的濃度增大,故a錯誤;
c.降低溫度,平衡向正反應方向移動,則CO的濃度減小,故c正確;
d.擴大容器體積,壓強減小,平衡向逆反應方向移動,但CO濃度減小,故d正確;
故答案為:cd;
③第一次平衡時c(N2)=0.2mol/L,c(CO)=0.8mol/L,c(CO2)=2c(N2)=0.4mol/L,c(NO)=$\frac{2.0mol}{2}$=0.6mol/L,
化學平衡常數K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$=$\frac{0.{4}^{2}×0.2}{0.{6}^{2}×0.{8}^{2}}$=$\frac{5}{36}$L/mol,
故答案為:$\frac{5}{36}$;
(2)2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-a kJ•mol-1①
2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1②
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1③
由①-②+2×③得 4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c) kJ•mol-1,
故答案為:4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c) kJ•mol-1;
(3)由圖可知,乙電極上有四氧化二氮生成,發生還原反應,則乙為陰極,故甲為陽極,N2O4在陽極失去電子,在硝酸條件下生成N2O5,根據電荷守恒可知,還有氫離子生成,電解池中生成N2O5的電極反應式是:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案為:陰;N2O4+2HNO3-2e-=2N2O5+2H+.
點評 本題考查化學平衡有關計算、化學平衡移動、化學反應速率計算、平衡常數計算及應用、熱化學方程式書寫、電解原理及電極反應式書寫等,屬于拼合型題目,化學平衡常數的有關計算是高考熱點,理解掌握化學平衡常數與濃度商的關系確定反應方向,(1)中②為易錯點,學生容易根據平衡移動判斷濃度變化,注意對平衡移動原理的理解:“減弱改變”而不是“消除改變”,也可以借助平衡常數理解.


科目:高中化學 來源: 題型:選擇題
| A. | Fe$→_{點燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | MgO$\stackrel{H_{2}SO_{4}}{→}$MgSO4(aq)$\stackrel{電解}{→}$Mg | |
| C. | 飽和NaCl(aq)$\underset{\stackrel{①N{H}_{3}}{→}}{②C{O}_{2}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | NH3$→_{催化劑,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=3的醋酸和pH=11的NaOH溶液等體積混合后,pH>7 | |
| B. | 若物質的量濃度相同的NH4Cl和NH3•H2O混合溶液pH>7,則在pH=7的NH4Cl和NH3•H2O混合溶液中:c(NH4+)>c(NH3•H2O) | |
| C. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3) | |
| D. | 0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等體積混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
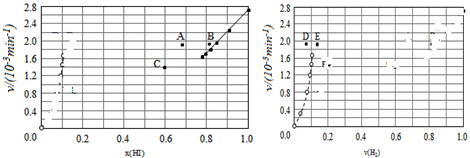
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題



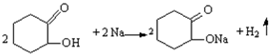 反應E→G的方程式為:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
反應E→G的方程式為:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液A和B均可以是鹽酸或NaOH溶液 | |
| B. | 若溶液B選用濃H2SO4,反應條件需要加熱,剩余固體為鋁 | |
| C. | 溶液A和B均不可選用稀HNO3 | |
| D. | 實驗室中方案Ⅱ更容易實施 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com