
在密閉容器中,當合成氨的反應N2+3H2===2NH3(正反應是放熱反應)達到平衡時,改變如下的一些條件:
(A)升溫,(B)加壓,(C)減壓,(D)增大c(H2),(E)減小c(NH3),(F)增大c(NH3),若平衡向右移動用“ →”,若平衡向左移動用“←”表示;若值增加用“↑”表示,若值減小用“↓”表示,請根據下表中各項的變化情況,在改變條件欄目中填上相應的編號(每項只改變一個條件)。
| 編號 | 改變條件 | 平衡移動方向 | N2的轉化率 | C(NH3) | C(N2) | C(H2) |
| ① | → | ↑ | ↓ | ↓ | ↓ | |
| ② | ← | ↓ | ↓ | ↑ | ↑ | |
| ③ | → | ↑ | ↑ | ↓ | ↑ | |
| ④ | ← | ↓ | ↓ | ↓ | ↓ | |
| ⑤ | → | ↑ | ↑ | ↑ | ↑ |
科目:高中化學 來源: 題型:閱讀理解
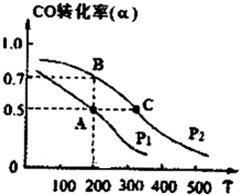 (2013?淄博一模)請運用化學反應原理的相關知識研究元素及其化合物的性質.
(2013?淄博一模)請運用化學反應原理的相關知識研究元素及其化合物的性質.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
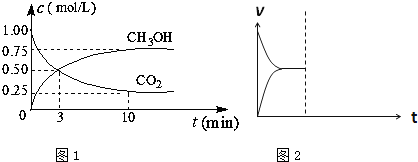
| 催化劑 |
| 溫度/k CO2轉化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省揚州市邗江區高二下學期期中考試化學試卷(帶解析) 題型:填空題
(14分)CO2可轉化成有機物實現碳循環。
(1)在體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,一定條件下發生反應: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。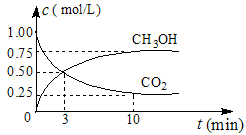
①從0 min到10 min,v(H2)= mol·(L·min)-1。
②能說明上述反應達到平衡狀態的是 (選填編號)。
A.反應中CO2與CH3OH的物質的量濃度之比為1︰1(即圖中交叉點)
B.容器內氣體的壓強不隨時間的變化而變化
C.單位時間內每消耗3 mol H2,同時生成1 mol H2O
D.CO2的體積分數在混合氣體中保持不變
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (選填編號)。
A.將H2O(g)從體系中分離 B.恒溫恒容充入He
C.恒溫恒壓充入He D.恒溫恒容再充入1 mol CO2和3 mol H2
(2)據報道,一定條件下由二氧化碳和氫氣合成二甲醚已成為現實。
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定壓強下,測得反應的實驗數據如下表。
分析表中數據回答下列問題:
①反應的溫度升高,K值 (填“增大”、“減小”或“不變”)。
②提高氫碳比[n(H2)/n(CO2)], K值 (填“增大”、“減小”或“不變”)。
(3)800℃時,C(s)+CO2(g) 2CO(g)的平衡常數K=1.64,相同條件下測得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向 (填“正”或“逆”)方向進行。
2CO(g)的平衡常數K=1.64,相同條件下測得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向 (填“正”或“逆”)方向進行。
(4)在密閉容器中通入1mol H2和1mol CO2發生H2(g)+CO2(g)  CO(g)+H2O(g) △H> 0反應,當反應達到平衡后,在其他條件不變時,若升高溫度,請在下圖中畫出正(v正)、逆(v逆)反應速率隨時間t變化的示意圖。
CO(g)+H2O(g) △H> 0反應,當反應達到平衡后,在其他條件不變時,若升高溫度,請在下圖中畫出正(v正)、逆(v逆)反應速率隨時間t變化的示意圖。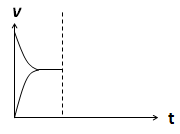
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(13分)光氣學名“碳酰氯”,化學式COCl2,是窒息性毒劑之一。
2-1 光氣化學性質活潑,具有酰鹵的典型反應,易發生水解、氨解和醇解。
(1)光氣與足量乙醇反應所得產物的化學名稱是 ;
(2)光氣與足量氨氣反應的化學方程式 ;
(3)足量苯在AlCl3催化劑作用下與光氣反應所得產物的結構簡式 ;
(4)光氣與苯胺分兩步反應可得異氰酸苯酯,中間產物的結構簡式是 ,異氰酸苯酯的結構簡式是 。
2-2 實驗室可用四氯化碳和發煙硫酸(H2SO4?SO3)反應制備光氣,寫出化學方程式。
2-3 BTC是一種穩定的白色結晶體,熔點為78~82℃,沸點為203~206℃。1mol BTC可在一定條件下分解產生3mol光氣,所以又被稱為“三光氣”。工業上可以利用碳酸二甲酯的氯代反應制備BTC。BTC的反應活性與光氣類似,可以和醇、醛、胺、酰胺、羧酸、酚、羥胺等多種化合物反應,因此低毒性的BTC在化學反應中完全可替代劇毒(被禁用)的光氣合成相關的化工產品。
(1)BTC分子中所有氯原子都等價,試寫出結構簡式
(2)除毒性外,BTC比光氣還有什么優點?
2-4 2004年6月15日福建省物質結構研究所(簡稱物構所)一下屬企業,因實驗操作不當造成有毒光氣泄漏。造成1人死亡,260多人送醫院救治。光氣遇熱按照下式分解:COCl2(g)=CO(g)+Cl2(g),Kp=4.44×10-2(668K,K為標準平衡常數),在密閉容器中,當混合氣體總壓力為300kPa時,計算該混合氣體的平均分子量。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com