
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | 硫酸鋁溶液跟碳酸氫鈉溶液反應:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3HDO+H+ |
分析 A.碳酸氫根離子水解生成碳酸和氫氧根離子;
B.NaHS水解生成硫化氫和氫氧根離子;
C.原子不守恒;
D.銨根離子水解結合水中氫氧根離子形成一水合氨和氫離子,依據過程分析判斷.
解答 解:A.HCO3-的水解方程式為:HCO3-+H2O?H2CO3+OH-,故A正確;
B.NaHS水解反應的離子反應為HS-+H2O?H2S+OH-,故B正確;
C.硫酸鋁溶液跟碳酸氫鈉溶液反應:Al3++3HCO3-?Al(OH)3↓+3CO2↑,故C錯誤;
D.NH4Cl溶于D2O中的反應離子方程式為:NH4++D2O?NH3•DHO+D+,故D錯誤.
故選A.
點評 本題考查鹽的水解原理的應用、離子反應方程式書寫的正誤判斷,明確鹽的水解原理和在離子反應中哪些物質應保留化學式及反應的實質是解答本題的關鍵,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
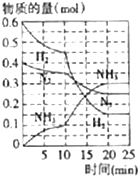 氨、燒堿在工農業生產和工業廢水處理中具有廣泛用途.回答下列問題:
氨、燒堿在工農業生產和工業廢水處理中具有廣泛用途.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
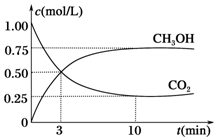 2009年10月15日新華社報道:全國農村應當在“綠色生態•美麗多彩•低碳節能•循環發展”的理念引導下,更快更好地發展“中國綠色村莊”,參與“亞太國際低碳農莊”建設.可見“低碳循環”已經引起了國民的重視,試回答下列問題:
2009年10月15日新華社報道:全國農村應當在“綠色生態•美麗多彩•低碳節能•循環發展”的理念引導下,更快更好地發展“中國綠色村莊”,參與“亞太國際低碳農莊”建設.可見“低碳循環”已經引起了國民的重視,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
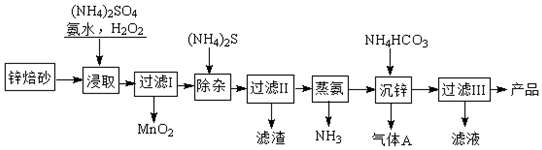
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 分類標準 | 能導電的物質 | 電解質 | 非電解質 |
| 屬于該類的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{32p}{17}$ g/L | B. | $\frac{17p}{32}$ g/L | C. | $\frac{32}{17p}$ g/L | D. | $\frac{17}{32p}$ g/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至剛好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 硫化鈉的水解:S2-+2H2O?H2S+2OH- | |
| C. | 向Fe(NO3)3溶液中加入過量的HI溶液:Fe3++3NO3-+10I-+12H+=5I2+Fe2++3NO↑+6H2O | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究化學反應中的能量變化有重要意義.請根據學過的知識回答下列問題:
研究化學反應中的能量變化有重要意義.請根據學過的知識回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com