

分析 原電池工作時,較為活潑的金屬為負極,較不活潑的金屬為正極,負極金屬失電子被氧化,正極發生還原反應,題給電解質溶液中,正極可生成銅或氫氣,以此解答該題.
解答 解:(1)負極是活潑金屬Zn失電子發生氧化反應,電極反應式為:Zn-2e-=Zn2+,正極上是電解質溶液中的氫離子得電子發生還原反應,電極反應式為:2H++2e-=H2↑,總反應式為:Zn+2H+=Fe2++H2↑,故答案為:Zn-2e-=Zn2+;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑;
(2)負極是活潑金屬Zn失電子發生氧化反應,電極反應式為:Zn-2e-=Zn2+,正極上是電解質溶液中的氫離子得電子發生還原反應,電極反應式為:2H++2e-=H2↑,總反應式為:Zn+2H+=Fe2++H2↑,故答案為:Zn-2e-=Zn2+;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑;
(3)負極是活潑金屬Zn失電子發生氧化反應,電極反應式為:Zn-2e-=Zn2+,正極上是電解質溶液中的銅離子得電子發生還原反應,電極反應式為:Cu2++2e-=Cu,總反應式為:Zn+Cu2+=Fe2++Cu,故答案為:Zn-2e-=Zn2+;Cu2++2e-=Cu;Zn+Cu2+=Fe2++Cu;
(4)負極是活潑金屬Fe失電子發生氧化反應,電極反應式為:Fe-2e-=Fe2+,正極上是電解質溶液中的氫離子得電子發生還原反應,電極反應式為:2H++2e-=H2↑,總反應式為:Fe+2H+=Fe2++H2↑,故答案為:Fe-2e-=Fe2+;2H++2e-=H2↑;Fe+2H+=Fe2++H2↑.
點評 本題考查了電極反應式書寫和電池反應式書寫,為高頻考點,側重于學生的分析能力的考查,注意把握原電池的工作原理,題目難度不大.


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:解答題
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子個數比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
 ,丁的結構式
,丁的結構式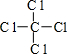
 ,最高價氧化物的水化物化學式為HClO4.
,最高價氧化物的水化物化學式為HClO4.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子組成中含碳氫原子個數比為1:2 | |
| B. | 能與溴發生加成反應而使溴水褪色,還能使酸性KMnO4溶液褪色 | |
| C. | 在空氣中燃燒能產生黑煙 | |
| D. | 完全燃燒生成等物質的量的CO2和H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2S+2HNO3=S↓+2NO2↑+2H2O | B. | Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O | ||
| C. | CuO+2HNO3=Cu(NO3)2+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬銫的熔點比金屬鈉高 | B. | CsOH比NaOH的堿性強 | ||
| C. | Cs與H2O能劇烈反應,但沒有鈉劇烈 | D. | 碳酸銫難溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
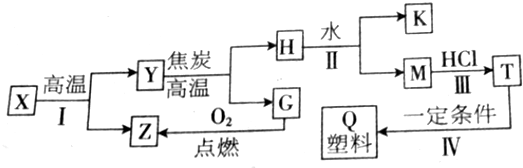

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com