
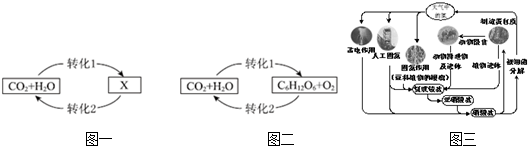
分析 (1)①水和二氧化碳反應生成碳酸,所以其反應的化學方程式為::CO2+H2O=H2CO3;
②綠色植物光合作用的過程是植物利用光在葉綠體內把二氧化碳和水合成為有機物和氧氣的過程;
③比較上面兩個反應可以看出:二者反應物相同,但是由于反應條件不同,導致二者的產物不同;
(2)①將氮元素由游離態轉化為化合態氮元素的過程稱為氮的固定;
②放電條件下,氮氣和氧氣反應生成一氧化氮;化合價降低的氮元素被還原;
③a、根據N元素的化合價升高被氧化,N元素的化合價降低被還原結合各反應中氮元素的化合價的變化分析;
b、人工固氮是人為的條件下將氮元素的單質轉化為化合物的過程;
c、根據氮循環中物質的分類進行解答;
d、碳、氫、氧三種元素也參加了氮循環,如大氣中的氮氣轉化氮的氧化物,氧元素參與,轉化為銨鹽,氫元素參加.
解答 解:(1)①水和二氧化碳反應生成碳酸,所以其反應的化學方程式為:CO2+H2O=H2CO3;故答案為:CO2+H2O=H2CO3;
②綠色植物光合作用的過程是植物利用光在葉綠體內把二氧化碳和水合成為有機物和氧氣的過程--綠色植物光合作用的過程,其反應的化學方程式為:6CO2+6H2O$\frac{\underline{\;葉綠體、光\;}}{\;}$C6H12O6+6O2;故答案為:6CO2+6H2O$\frac{\underline{\;葉綠體、光\;}}{\;}$C6H12O6+6O2;
③比較上面兩個反應可以看出:二者反應物相同,但是由于反應條件不同,導致二者的產物不同;故答案為:反應條件不同;
(2)①將氮元素由游離態轉化為化合態氮元素的過程稱為氮的固定,故答案為:化合態;
②放電條件下,氮氣和氧氣反應生成一氧化氮,反應方程式為:N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO,氮元素化合價升高,被氧化,故答案為:N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO;氧化;
③a.碳、氫、氧三種元素也參與了氮循環,如硝酸鹽中氮元素的化合價為+5價,被細菌分解變成大氣中氮單質,氮元素由+5→0,屬于被還原,故錯誤;
b.工業合成氨是將N2與H2在一定條件下反應生成NH3,屬于人工固氮,故正確;
c.氮循環中銨鹽和蛋白質可相互轉化,銨鹽屬于無機物,蛋白質屬于有機物,含氮無機物和含氮有機物可相互轉化,故正確;
d.碳、氫、氧三種元素也參加了氮循環,如蛋白質的制造需要碳元素,又如N2在放電條件下與O2直接化合生成無色且不溶于水的一氧化氮氣體,N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO,氧元素參與,二氧化氮易與水反應生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO,氫元素參加,故正確.
故選a.
點評 本題主要考查了碳(氮)元素在自然界中的循環、氮(碳)以及化合物的性質,理解氧化還原反應、人工固氮等知識點是解答的關鍵,題目難度不大.


 開心蛙狀元測試卷系列答案
開心蛙狀元測試卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn與稀H2SO4反應:Zn+2H+═Zn2++H2↑ | |
| B. | 鐵和稀硝酸反應:Fe+2H+═Fe2++H2↑ | |
| C. | Cl2與NaOH溶液反應:Cl2+2OH-═2Cl-+H2O | |
| D. | 碳酸鈣溶于鹽酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.8 g的NH4+中含有的電子數為0.1×6.02×1023 | |
| B. | 常溫常壓下,11.2 L氯氣所含的原子數為6.02×1023 | |
| C. | 常溫常壓下,18 g H2O含有的原子數為3×6.02×1023 | |
| D. | 5.6 g金屬鐵變為離子時失去的電子數為0.2×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
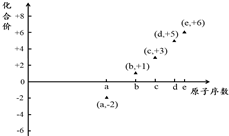 如圖是部分短周期元素的原子序數與其某種常見化合價的關系圖,若用原子序數代表所對應的元素,則下列說法正確的是( )
如圖是部分短周期元素的原子序數與其某種常見化合價的關系圖,若用原子序數代表所對應的元素,則下列說法正確的是( )| A. | 31d和33d屬于同種核素 | B. | 氣態氫化物的穩定性:a>d>e | ||
| C. | 工業上常用電解法制備單質b和c | D. | a和b形成的化合物不可能含共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
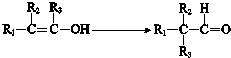
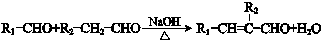
 .
.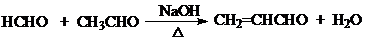 .
.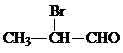 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃堿飛濺到皮膚上,應立刻涂上硫酸溶液 | |
| B. | 金屬鈉著火,立刻用水撲滅 | |
| C. | 加熱試管時,先來回移動酒精燈加熱,再對準藥品集中加熱 | |
| D. | 實驗剩余氯氣可直接排放到實驗室外 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com