
| A. | 消耗氧氣的體積為1.68 L | |
| B. | 混合氣體中含NO21.12 L | |
| C. | 此反應過程中轉移的電子為0.3 mol | |
| D. | 參加反應的硝酸是0.4mol |
分析 標況下2.24L混合氣體的物質的量為:$\frac{2.24L}{22.4L/mol}$=0.1mol,則n(NO2)+n(NO)=0.1,得失電子守恒知:n(NO2)+3n(NO)=0.2,4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,則消耗NaOH溶液的體積是50mL,反應消耗的銅的物質的量為4mol•L-1×50×10-3L×$\frac{1}{2}$=0.1mol,0.1mol銅完全反應失去0.2mol電子,根據電子守恒,氧氣得到的電子與銅失去的電子一定相等,根據電子守恒計算出消耗氧氣物質的量,由此分析解答.
解答 解:標況下2.24L混合氣體的物質的量為:$\frac{2.24L}{22.4L/mol}$=0.1mol,則n(NO2)+n(NO)=0.1,得失電子守恒知:n(NO2)+3n(NO)=0.2,解得n(NO2)=0.05mol,n(NO)=0.05mol,4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,則消耗NaOH溶液的體積是50mL,反應消耗的銅的物質的量為4mol•L-1×50×10-3L×$\frac{1}{2}$=0.1mol,0.1mol銅完全反應失去0.2mol電子,
A、消耗氧氣的體積為$\frac{0.2}{4}$×22.4=1.12 L,故A錯誤;
B、因為n(NO2)=0.05mol,所以V(NO2)=0.05mol×22.4L/mol=1.12 L,故B正確;
C、此反應過程中轉移的電子為0.2 mol,故C錯誤;
D、參加反應的硝酸是0.1mol+0.2mol=0.3mol,故D錯誤;
故選B.
點評 本題考查了有關離子反應的計算,題目難度中等,明確銅過量及發生反應原理為解答關鍵,轉移電子守恒、質量守恒在化學計算中的應用方法.


科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3能與堿反應,可用作焙制糕點的膨松劑 | |
| B. | 液氨汽化時吸收大量的熱,可用作制冷劑 | |
| C. | 硅酸鈉溶液呈堿性,可用作木材防火劑 | |
| D. | Fe比Cu活潑,可用FeCl3溶液腐蝕線路板上的Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 陰極增重1.72g | B. | 所得溶液 pH<1 | C. | 陰極增重0.64g | D. | 所得溶液pH>1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L NH3溶于水后溶液中含有NA個NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA個Na+ | |
| C. | 1 mol 硫酸鉀中陰離子所帶電荷數為NA | |
| D. | 將0.1mol氯化鐵溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
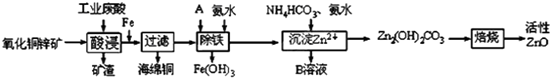
| 離子 | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaH在水中顯堿性 | |
| B. | NaH中氫離子電子層排布與氦原子相同 | |
| C. | NaH中氫離子半徑比鋰離子半徑大 | |
| D. | NaH中氫離子被還原為H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大反應物濃度,可增大單位體積內活化分子的百分數,從而使有效碰撞次數增多 | |
| B. | 有氣體參加的反應,若增大壓強,可增大活化分子的百分數,從而使反應速率增大 | |
| C. | 升高溫度能使反應速率增大的主要原因是減小了反應物分子中活化分子的百分數 | |
| D. | 催化劑能增大活化分子的百分數,從而成千上萬倍地增大反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X、Y、Z、W 元素的離子半徑依次減小 | |
| B. | W 的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點 | |
| C. | 若W 與Y的原子序數相差5,則二者形成的化合物的化學式可能為Y2W3或Y3W2 | |
| D. | W 與X形成的化合物只含離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com