

分析 (1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1;②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1,依據蓋斯定律,①-②×3,計算反應熱;
(2)①平衡常數等于生成物的濃度系數次冪之積除以反應物濃度系數次冪之積;
②根據溫度對平衡移動的影響判斷反應熱的符號;
③曲線Ⅱ到達平衡所用時間較短,則該條件下溫度高,升高溫度平衡逆移;
(3)①用硫酸溶液作電解質進行電解,CO2失電子轉化為甲烷;
②已知常溫下一水合氨Kb=1.8×10-5,碳酸一級電離常數Ka=4.3×10-7,所以碳酸氫根離子的水解能力強于銨根離子.
解答 解:(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依據蓋斯定律,①-②×3得Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),故△H=489.0kJmol-1-3×172.5kJmol-1=-28.5kJmol-1,
故答案為:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),其平衡常數K=$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$,故答案為:$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$;
②根據圖象可知達到平衡后,溫度越高,甲醇的體積分數φ(CH3OH)越小,說明升高溫度平衡逆移,則正反應方向為放熱反應,則△H<0,故答案為:<;
③根據圖象可知曲線Ⅱ到達平衡所用時間較短,則該條件下溫度高,升高溫度平衡逆移,平衡常數減小,則曲線Ⅱ條件下平衡常數較小,即KⅠ>KⅡ;
故答案為:>;
(3)①用硫酸溶液作電解質進行電解,CO2失電子轉化為甲烷,則其電極方程式為:CO2+8H+-8e-=CH4+2H2O,故答案為:CO2+8H+-8e-=CH4+2H2O;
②已知常溫下一水合氨Kb=1.8×10-5,碳酸一級電離常數Ka=4.3×10-7,所以碳酸氫根離子的水解能力強于銨根離子,所以 NH4HCO3顯堿性,故答案為:堿性.
點評 本題綜合性考查了蓋斯定律的應用、平衡常數的表達式及影響因素的判斷、電極方程式的書寫等,側重于對基礎知識的綜合應用的考查,題目難度中等,側重于考查學生的分析能力和解決問題的能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 電池放電時Li+向負極移動 | |
| B. | 電池放電時,正極的電極反應式為:2Li++Li2O2+2e-═2Li2O | |
| C. | 電池充電時,Li極應與外電源的正極相連 | |
| D. | 電池系統內進入二氧化碳及水對電池性能不會產生影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
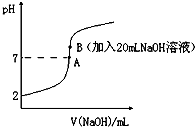 氫氟酸(HF)是一元弱酸,在水溶液中的電離方程式為:HF═H++F-.25℃下,向20mL0.2mol•L-1的氫氟酸中滴加0.2mol•L-1的NaOH溶液時,溶液的pH變化如圖所示.
氫氟酸(HF)是一元弱酸,在水溶液中的電離方程式為:HF═H++F-.25℃下,向20mL0.2mol•L-1的氫氟酸中滴加0.2mol•L-1的NaOH溶液時,溶液的pH變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④⑥ | B. | ②⑤ | C. | ③⑤⑥⑧ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 淀粉尚有部分未水解 | |
| B. | 淀粉已完全水解 | |
| C. | 淀粉沒有水解 | |
| D. | 淀粉已發生水解,但不知是否水解完全 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com