
 用CaSO4代替O2與燃料CO反應,既可提高燃燒效率,又能得到高純CO2,是一種高效、清潔、經濟的新型燃燒技術,反應①為主反應,反應②和③為副反應.
用CaSO4代替O2與燃料CO反應,既可提高燃燒效率,又能得到高純CO2,是一種高效、清潔、經濟的新型燃燒技術,反應①為主反應,反應②和③為副反應. .
. 分析 (1)已知:①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ?mol-1
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ?mol-1
根據蓋斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g);
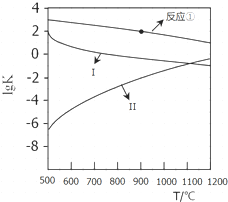
(2)由圖可知,當△H>0時,lgK隨溫度升高而增大,當△H<0時,lgK隨溫度升高而減小;當溫度同等變化時,△H的數值越大lgK的變化越大;
(3)900℃時反應①的lgK=2,則平衡常數為102,設出反應前CO濃度為cmol/L,根據平衡常數K=$\frac{c(C{O}_{2})}{c(CO)}$列方程計算解答;
(4)混合氣體中含有二氧化硫,可以用碳酸鈣進行吸收;
(5)以反應①中生成的CaS為原料,在一定條件下經原子利用率100%的高溫反應,可再生CaSO4,則另一種反應為氧氣;在一定條件下,CO2可與對二甲苯反應,在其苯環上引入一個羧基,相當于用羧基取代苯環上的氫原子.
解答 解:(1)已知:①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ?mol-1
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ?mol-1
根據蓋斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g),則△H=4△H1+△H2+2△H3,
故答案為:4△H1+△H2+2△H3;
(2)反應①、③為放熱反應,隨著溫度的升高,平衡常數K逐漸減小,則lgK逐漸減小,而反應②為吸熱反應,升高溫度,平衡常數K逐漸增大,則lgK逐漸增大,所以Ⅰ表示的為反應③、Ⅱ曲線表示的為反應②,可得變化規律為:當△H>0時,lgK隨溫度升高而增大,當△H<0時,lgK隨溫度升高而減小;
根據反應①和曲線Ⅰ(反應③反應)的反應熱可知,當溫度同等變化時,△H的數值越大lgK的變化越大,
故答案為:當△H>0時,lgK隨溫度升高而增大,當△H<0時,lgK隨溫度升高而減小;當溫度同等變化時,△H的數值越大lgK的變化越大;
(3)向盛有CaSO4的真空恒容密閉容器中充入CO,反應方程式為:$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g),根據圖象曲線可知,反應①于900℃時lgK=2,平衡常數為102=100,c平衡(CO)=8.0×10-5 mol•L-1,設一氧化碳反應前濃度為c,則反應消耗的CO濃度=反應生成二氧化碳濃度=(c-8.0×10-5)mol/L,平衡常數K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{c-8.0×1{0}^{-5}}{8.0×1{0}^{-5}}$=100,解得c=8.08×10-3,一氧化碳的轉化率為:$\frac{8.0×1{0}^{-3}}{8.08×1{0}^{-3}}$×100%≈99%,
答:CO的轉化率為99%;
(4)混合氣體中含有二氧化硫,在原料中加入適量碳酸鈣,吸收二氧化硫,有利于獲得更純凈的CO2,
故答案為:碳酸鈣;
(5)以反應①中生成的CaS為原料,在一定條件下經原子利用率100%的高溫反應,可再生CaSO4,則另一種反應為為氧氣,該反應的化學方程式為:CaS+2O2$\frac{\underline{\;高溫\;}}{\;}$CaSO4;在一定條件下,CO2可與對二甲苯反應,在其苯環上引入一個羧基,相當于用羧基取代苯環上的氫原子,對二甲苯中苯環上4個H原子位置等價,則該產物的結構簡式為: ,
,
故答案為:CaS+2O2$\frac{\underline{\;高溫\;}}{\;}$CaSO4; .
.
點評 本題考查化學平衡計算、化學平衡常數、圖象分析、燃燒熱計算等,題目難度中等,注意掌握化學平衡常數的概念及計算方法.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ;Na2O2的電子式
;Na2O2的電子式 .
.| 非金屬性 | 離子半徑 | 熱穩定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 低碳生活就是節能減排,使用太陽能等代替化石燃料,可減少溫室氣體的排放 | |
| B. | 新能源的優點主要是資源豐富、可再生、沒有或很少有污染 | |
| C. | 氫能的優點熱值高、資源豐富、燃燒產物無污染;缺點是儲存和運輸困難 | |
| D. | 高純度的硅單質廣泛用于制作光導纖維 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X溶液 | 固體Y | Z溶液 | 現象 |  |
| A | 稀硫酸 | 亞硫酸氫鈉 | 品紅試劑 | 品紅褪色 | |
| B | 濃氨水 | CaO | 紫色石蕊試液 | 溶液變紅 | |
| C | 鹽酸 | 石灰石 | 硅酸鈉溶液 | 出現白色沉淀 | |
| D | 雙氧水 | MnO2 | 氫硫酸溶液 | 產生渾濁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com