
【題目】設NA表示阿伏加德羅常數的值,下列說法錯誤的有
①17.6g丙烷中所含的共價健數為4 NA
②常溫下,21gC3H6和C4H8的混合物中含有的碳原子數為1.5 NA
③電解硫酸銅溶液,往電解后的溶液中加入氧化銅一定可以使溶液恢復到原來的狀態
④2gD216O中含有的質子數、中子數、電子數均為NA
⑤1.0L、pH=13的NaOH溶液中,OH-離子數目一定為0.1 NA
⑥將100mL、0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3膠粒0.01 NA
A. 2項 B. 3項 C. 4項 D. 5項
【答案】B
【解析】分析: (1)丙烷分子中含有2個碳碳鍵、8個碳氫鍵,總共含有10個共價鍵;(2)丙烯與丁烯的最簡式相同,均為CH2,根據最簡式計算;(3) 電解硫酸銅溶液,若陰極無氫氣產生,往電解后的溶液中加入氧化銅一定可以使溶液恢復到原來的狀態,若有氫氣產生,則不是;(4)D216O中含有質子數=核外電子數=2+8=10,中子數=(2-1)×2+(16-8)=10,質量數為4+16=20,所以2gD216O中含有的質子數、中子數、電子數均為1mol;
(5)未指明溫度無法計算;(6)Fe(OH)3膠體粒子為氫氧化鐵的聚集體。
詳解:(1)丙烷的相對分子質量是44,所以17.6g丙烷的物質的量是0.4mol,因為每1mol的該物質中含有共價鍵10mol,所以0.4mol中所含的極性共價鍵為4NA,故(1)正確;
(2)丙烯與丁烯的最簡式相同,均為CH2,21gC3H6和C4H8的混合物中含有的碳原子數為![]() =1.5NA,故(2)正確;
=1.5NA,故(2)正確;
(3) 若只電解電解硫酸銅溶液,陰極無氫氣產生,往電解后的溶液中加入氧化銅一定可以使溶液恢復到原來的狀態,若后期電解水,有氫氣產生,則不能;故(3)錯誤;
(4) D216O中含有質子數=核外電子數=2+8=10,中子數=(2-1)×2+(16-8)=10,質量數為4+16=20,所以2gD216O中含有的質子數、中子數、電子數均為1mol,故(4)正確;
(5) 沒有指明是常溫,無法計算氫氧根離子濃度,故(5)錯誤;
(6) Fe(OH)3膠體粒子為氫氧化鐵的聚集體,無法計算膠體中含有的膠粒數目,故(6)錯誤;
③⑤⑥錯誤,所以本題選B。


 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】為除去下列物質中所含的雜質,所選用的試劑或操作方法錯誤的是( )
序號 | 物質 | 雜質 | 試劑或方法 |
A |
|
| 加熱至恒重 |
B |
|
| 通入過量二氧化碳 |
C |
|
| 加入過量銅粉并過濾 |
D |
|
| 通入氯氣 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二溴乙烷可作汽油抗爆劑的添加劑,在實驗室中可以用下圖所示裝置制備1,2-二溴乙烷.其中A和F中裝有乙醇和濃硫酸的混合液,D中的試管里裝有液溴.可能存在的主要副反應有:乙醇在濃硫酸的存在下在l40℃脫水生成乙醚。(夾持裝置已略去)

有關數據列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | 一l30 | 9 | -1l6 |
填寫下列空白:
(1)A中主要發生的是乙醇的脫水反應,即消去反應,請你寫出乙醇的這個消去反應的化學方程式: 。
D中發生反應的化學方程式為: 。
(2)安全瓶B可以防止倒吸,并可以檢查實驗進行時導管是否發生堵塞.請寫出發生堵塞時瓶B中的現象 。
(3)在裝置C中應加入 ,其目的是吸收反應中可能生成的酸性氣體:(填正確選項前的字母)
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(4)容器E中NaOH溶液的作用是 。
(5)若產物中有少量副產物乙醚.可用________(填操作名稱)的方法除去。
(6)反應過程中應用冷水冷卻裝置D,其主要目的是乙烯與溴反應時放熱,冷卻可避免溴的大量揮發;但又不能過度冷卻(如用冰水),其原因是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A可以作水果的催熟劑,D是食醋的主要成分。相關的轉化關系如下:

請回答下列問題:
(1)A的結構簡式為______________,C的名稱是_________________。
(2)反應①的反應類型是______________。
(3)反應③的化學方程式為__________________,該反應類型是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2為原料可制備N2H4·H2O(水合肼)和無水Na2SO3,其主要實驗流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放熱反應。
ClO+Cl+H2O是放熱反應。
②N2H4·H2O沸點約118 ℃,具有強還原性,能與NaClO劇烈反應生成N2。
(1)步驟Ⅰ制備NaClO溶液時,若溫度超過40 ℃,Cl2與NaOH溶液反應生成NaClO3和NaCl,其離子方程式為____________________________________;實驗中控制溫度除用冰水浴外,還需采取的措施是____________________________________。
(2)步驟Ⅱ合成N2H4·H2O的裝置如題19圖1所示。NaClO堿性溶液與尿素水溶液在40 ℃以下反應一段時間后,再迅速升溫至110 ℃繼續反應。實驗中通過滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步驟Ⅳ用步驟Ⅲ得到的副產品Na2CO3制備無水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 隨pH的分布如題19圖2所示,Na2SO3的溶解度曲線如題19圖3所示)。
隨pH的分布如題19圖2所示,Na2SO3的溶解度曲線如題19圖3所示)。
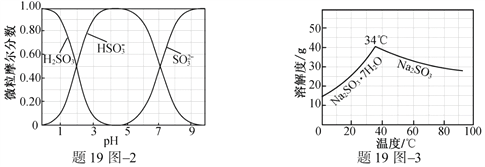
①邊攪拌邊向Na2CO3溶液中通入SO2制備NaHSO3溶液。實驗中確定何時停止通SO2的實驗操作為_________________。
②請補充完整由NaHSO3溶液制備無水Na2SO3的實驗方案: _______________________,用少量無水乙醇洗滌,干燥,密封包裝。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,a、b是石墨電極,通電一段時間后,b極附近溶液顯紅色。下列說法正確的是( )

A. X極是電源負極,Y極是電源正極
B. a極的電極反應是2Cl--2e-=Cl2↑
C. 電解過程中CuSO4溶液的pH逐漸增大
D. Pt極上有6.4 g Cu析出時,b極產生2.24 L(標準狀況)氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】V mL密度為ρ g·mL-1的某溶液中,含有相對分子質量為M的溶質m g,該溶液中溶質的質量分數為w%,物質的量濃度為c mol·L-1,那么下列關系式正確的是( )
A. ![]()
![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某電池以K2FeO4和Zn為電極材料,KOH溶液為電解溶質溶液。下列說法正確的是
A. 電池工作時OH-向負極遷移
B. 正極反應式為2Fe![]() +
+![]() =Fe2O3+5H2O
=Fe2O3+5H2O
C. 該電池放電過程中電解質溶液濃度不變
D. 電子由Zn電極流出,經KOH溶液流向正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組為研究電化學原理,設計如圖裝置,下列敘述不正確的是

A. a和b不連接時,鐵片上會有金屬銅析出
B. a和b用導線連接時,鐵片上發生的反應為: Fe2e===Fe2+
C. a和b用導線連接時,電子從Cu片流向鐵片
D. a和b用導線連接時,Cu2+向銅電極移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com