
分析 I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
則依據蓋斯定律計算①×$\frac{3}{2}$-②得到反應:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的熱化學方程式得到反應的焓變;
Ⅱ.(1)令平衡時CO的物質的量變化為nmol,利用三段式表示出平衡時CO、CO2的物質的量,化學計量數都是1,利用物質的量代替濃度代入平衡常數計算n的值,進而計算CO的濃度變化量,再利用轉化率定義計算CO的轉化率;
(2)a.該反應正反應是放熱反應,提高反應溫度,平衡向逆反應移動;
b.反應前后氣體的物質的量不變,減小容器的容積,增大壓強平衡不移動;
c.加入合適的催化劑,平衡不移動;
d.移出部分CO2,平衡向正反應移動;
e.粉碎礦石,使其與平衡混合氣體充分接觸,平衡不移動;
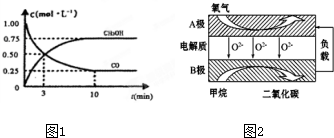
Ⅲ.(3)根據v=$\frac{△c}{△t}$計算v(CH3OH),再利用速率之比等于化學計量數之比計算v(H2);
(4)平衡時混合氣體密度是同溫同壓下起始時的1.6倍,則總物質的量變為原先的$\frac{5}{8}$倍,據此判斷反應的方向;
(5)由陰離子移動方向可知B為負極,負極上甲烷失電子發生氧化反應,甲烷被氧化生成二氧化碳和水:2Cu2++2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+4H+,結合電子守恒計算消耗甲烷的體積.
解答 解:I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-825.5kJ/mol
則依據蓋斯定律計算①×$\frac{3}{2}$-②得到反應:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5KJ/mol,
故答案為:23.5;
Ⅱ.(1)令平衡時CO的物質的量變化為nmol,則:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
開始(mol):1 1
變化(mol):n n
平衡(mol):1-n n+1
所以 $\frac{n+1}{1-n}$=4,解得n=0.6,則CO的平衡轉化率為 $\frac{0.6mol}{1mol}$×100%=60%,
故答案為:60%;
(2)a.該反應正反應是放熱反應,提高反應溫度,平衡向逆反應移動,CO的平衡轉化率降低,故a錯誤;
b.反應前后氣體的物質的量不變,減小容器的容積,增大壓強平衡不移動,CO的平衡轉化率不變,故b錯誤;
c.加入合適的催化劑,平衡不移動,故c錯誤;
d.移出部分CO2,平衡向正反應移動,CO的平衡轉化率增大,故d正確;
e.粉碎礦石,使其與平衡混合氣體充分接觸,可以加快反應速率,但平衡不移動,故e錯誤;
故答案為:d;
Ⅲ.(3)由圖可知,達到平衡時甲醇的濃度變化為0.75mol/L,則v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化學計量數之比,v(H2)=2v(CH3OH)=0.15mol/(L•min),
故答案為:0.15mol/(L•min);
(4)反應前后氣體總質量不變,同溫、同壓下,達到平衡時,氣體密度增大,即氣體體積縮小;平衡時混合氣體密度是同溫同壓下起始時的1.6倍,則總物質的量變為原先的$\frac{5}{8}$倍,總物質的量=4×$\frac{5}{8}$=2.5mol,反應前后減少了1.5mol,即化學反應向著正反應方向進行,
故答案為:正;
(5)①燃料電池中燃料在負極發生氧化反應,甲烷失電子在熔融鹽中生成二氧化碳氣體,B極上的電極反應式為:CH4-8e-+402-=CO2+2H2O,
故答案為:CH4-8e-+402-=CO2+2H2O;
②若用該燃料電池做電源,用石墨做電極電解硫酸銅溶液,當陽極收集到11.2L(標準狀況)氣體位氧氣,物質的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,電極反應為4OH--4e-=2H2O+O2↑,結合單質守恒和電極反應得到 CH4-8e-+402-=CO2+2H2O,CH4~8e-~2O2,則消耗甲烷物質的量0.25mol,標準狀況下的體積=0.25mol×22.4L/mol=5.6L,故答案為:5.6;
點評 本題綜合考查了化學平衡計算、等效平衡等,Ⅱ中等效平衡的計算,為該題的難點,也是易錯點,注意理解等效平衡問題,思維量大,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
| 組別 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 在$\frac{C{u}_{2}O}{ZnO}$做催化劑的條件下,將1molCO(g)和2molH2(g)充入容積為2L的密閉容器中合成CH3OH(g),反應過程中,CH3OH(g)的物質的量(n)與時間(t)及溫度的關系如圖所示:
在$\frac{C{u}_{2}O}{ZnO}$做催化劑的條件下,將1molCO(g)和2molH2(g)充入容積為2L的密閉容器中合成CH3OH(g),反應過程中,CH3OH(g)的物質的量(n)與時間(t)及溫度的關系如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 甲 | 乙 | 丙 | 丁 | ||
| 密閉容器體積/L | 2 | 2 | 2 | 1 | |
| 起始物質的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡轉化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反應的平衡常數小于乙 | |
| B. | 該溫度下,該反應的平衡常數K為400 | |
| C. | SO2的平衡轉化率:α1>α2=α3 | |
| D. | 容器中SO3的物質的量濃度:丙=丁<甲 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
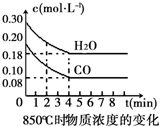 在一體積為10L的容器中,通入一定量的CO和H2O(g),在850℃時發生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)濃度變化如圖
在一體積為10L的容器中,通入一定量的CO和H2O(g),在850℃時發生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)濃度變化如圖| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol任何物質所含有的原子數都相同 | |
| B. | 摩爾是物質的量的單位,簡稱摩,符號為mol | |
| C. | 摩爾可以把物質的宏觀數量與微觀粒子的數量聯系起來 | |
| D. | 國際上規定,0.012 kg C中所含有的碳原子數目為1摩 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
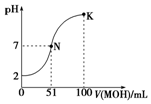 常溫下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計).回答下列問題:
常溫下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計).回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過量的銅與濃硝酸反應有一氧化氮生成 | |
| B. | Al、Fe、Cu的單質放置在空氣中均只生成氧化物 | |
| C. | SiO2與酸、堿均不反應 | |
| D. | 向一定濃度的Na2SiO3溶液中通入適量CO2氣體,出現白色沉淀,則H2SiO3的酸性比H2CO3的酸性強 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com