
 A-F六種元素中,除C外其他均為短周期元素,它們的原子結構或性質如下表所示:請回答下列問題:
A-F六種元素中,除C外其他均為短周期元素,它們的原子結構或性質如下表所示:請回答下列問題:| 元素 | 結構或性質 |
| A | 原子最外層電子數是內層電子總數的$\frac{1}{5}$ |
| B | 形成化合物種類最多的元素,其單質為固體 |
| C | 生活中常見的金屬,它有兩種常見的氯化物,且相對分子質量相差35.5 |
| D | 地殼中含量最多的元素 |
| E | 與D同主族 |
| F | 與E同周期,且最外層電子數等于電子層數 |
 .
.分析 A-F六種元素中,除C外均為短周期元素,A原子最外層電子數是內層電子數的$\frac{1}{5}$,則A原子有3個電子層,最外層電子數為2,故A為Mg元素;B是形成化合物種類最多的元素之一,其單質為固體,則B為碳元素;C是生活中常見的金屬,它有兩種氯化物,相對分子質量相差35.5,結合C的某種氯化物的濃溶液可用于制作印刷電路板,可知C為Fe元素;D是地殼中含量最多的元素,則D為氧元素;E與D同主族,則E為硫元素;F與E同周期,且最外層電子數等于電子層數,處于第三周期,最外層電子數為3,則F為Al元素,據此解答.
解答 解:A-F六種元素中,除C外均為短周期元素,A原子最外層電子數是內層電子數的$\frac{1}{5}$,則A原子有3個電子層,最外層電子數為2,故A為Mg元素;B是形成化合物種類最多的元素之一,其單質為固體,則B為碳元素;C是生活中常見的金屬,它有兩種氯化物,相對分子質量相差35.5,結合C的某種氯化物的濃溶液可用于制作印刷電路板,可知C為Fe元素;D是地殼中含量最多的元素,則D為氧元素;E與D同主族,則E為硫元素;F與E同周期,且最外層電子數等于電子層數,處于第三周期,最外層電子數為3,則F為Al元素.
(1)A為Mg元素,處于周期表中第3周期ⅡA族,A與E形成的化合物為MgS,其電子式是 ,
,
故答案為:第3周期ⅡA族; ;
;
(2)氯化鐵溶液與銅反應生成氯化亞鐵、氯化銅,反應離子方程式為:2Fe3++Cu═2Fe2++Cu2+,
故答案為:2Fe3++Cu═2Fe2++Cu2+;
(3)碳與水蒸氣在高溫條件下生成CO與氫氣,反應方程式為:C+H2O $\frac{\underline{\;高溫\;}}{\;}$ CO+H2,
故答案為:C+H2O $\frac{\underline{\;高溫\;}}{\;}$ CO+H2;
(4)氯化鋁溶液中鋁離子水解:Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,C、D形成的相對分子質量為160的化合物為Fe2O3,與Al再高溫下發生鋁熱反應生成Fe與氧化鋁,反應化學方程式是:2Al+Fe2O3 $\frac{\underline{\;高溫\;}}{\;}$ 2Fe+Al2O3,
故答案為:Al3++3H2O?Al(OH)3+3H+;2Al+Fe2O3 $\frac{\underline{\;高溫\;}}{\;}$ 2Fe+Al2O3;
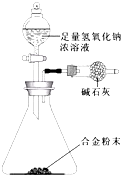
(5)①Mg與Al形成的合金是工業上重要的材料.某同學僅使用天平和右圖所示的裝置測定某些數據即可求出該合金中Mg元素的含量,該原理是根據反應前后裝置的質量差測定生成氫氣的質量,根據合金的質量與生成氫氣的質量計算合金中各金屬的質量,進而計算Mg的含量,故實驗需要測定三個物理量:合金的質量m、反應前裝置和藥品的總質量、反應后裝置和藥品的總質量,
故答案為:反應前裝置和藥品的總質量;反應后裝置和藥品的總質量;
②生成氫氣的質量為(a-b)g,令合金中Mg的質量分數為x,則Al的質量分數為(1-x),Mg的質量為mxg,Al的質量為m(1-x),根據電子轉移守恒有:$\frac{mx}{24}$×2+$\frac{m(1-x)}{27}$×3=$\frac{(a-b)}{2}$×2,
解得x=$\frac{4m-36a+36b}{m}$,
故答案為:$\frac{4m-36a+36b}{m}$.
點評 本題考查結構性質位置關系、化學實驗等,難度中等,推斷元素是解題的關鍵,(5)為易錯點、難點,注意根據裝置圖理解實驗原理.


科目:高中化學 來源: 題型:選擇題
| A. | 水玻璃可用作木材的防火劑 | |
| B. | Na2O2可用于潛水員的呼吸面具中的供氧劑 | |
| C. | 對“地溝油”蒸餾可以獲得汽油 | |
| D. | 石英具有很好的導光性,可用于生產光導纖維 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HNO3═NaNO3+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中可能含有共價鍵,共價化合物中可能含有離子鍵 | |
| B. | 一定條件下1 mol N2與3 mol H2在密閉容器中充分反應可生成2 mol NH3 | |
| C. | 鐵質器件附有銅質配件,在接觸處易生鐵銹 | |
| D. | 非極性共價鍵只存在于雙原子單質分子里 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 加水稀釋至溶液體積為200 mL,醋酸溶液的pH變為4 | |
| B. | 溫度都升高20℃后,兩溶液的pH不再相等 | |
| C. | 加水稀釋至溶液體積為200 mL后,兩種溶液中c(OH-)都減小 | |
| D. | 加足量的鋅充分反應后,兩溶液中產生的氫氣體積可用右圖表示 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com