
分析 此題實質上是分析發生的連續反應的分段情況.
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2 ①
2Na2O2+2CO2=2Na2CO3+O2 ②
2Na2O2+2H2O=4NaOH+O2 ③
當發生反應①、②且完全反應時,則有Na2CO3、H2O和O2,$\frac{a}{b}$=$\frac{1}{2}$;若Na2O2不足,則CO2有剩余,則$\frac{a}{b}$<$\frac{1}{2}$.
當發生反應①、②、③且完全反應時,a=b,$\frac{a}{b}$=1,有Na2CO3、NaOH和O2;若Na2O2不足以與水完全反應,則水蒸氣有剩余,$\frac{a}{b}$<1;若Na2O2有剩余,則$\frac{a}{b}$>1,由此分析解答.
解答 解:(1)當剩余固體只有碳酸鈉時,則過氧化鈉恰好和二氧化碳完全反應,發生的反應方程式為2NaHCO3+Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2CO3+H2O+$\frac{1}{2}$O2,所以,$\frac{a}{b}$的值為$\frac{1}{2}$,故答案為:$\frac{1}{2}$;
(2)當剩余固體為Na2CO3、NaOH,排出氣體為O2、H2O時,由于有NaOH生成,所以有水與Na2O2反應.假設反應后無H2O生成,將方程式①×2+②+③得:2NaHCO3+2Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2CO3+2NaOH+O2↑,由方程式可知此時$\frac{a}{b}=1$,因為有水生成,所以$\frac{1}{2}<\frac{a}{b}<1$,故答案為:$\frac{1}{2}<\frac{a}{b}<1$;
(3)當$\frac{a}{b}>1$時,由(2)討論可知:剩余固體為Na2CO3、NaOH、Na2O2;排出氣體為O2,故答案為:當剩余固體為Na2CO3,排出氣體為O2;
(4)2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2 ①
2 1 1
b $\frac{b}{2}$ $\frac{b}{2}$
2Na2O2+2CO2=2Na2CO3+O2 ②
2 2 1
$\frac{b}{2}$ $\frac{b}{2}$ $\frac{b}{4}$
2Na2O2+2H2O=4NaOH+O2 ③
2 2 1
x x $\frac{x}{2}$
排出的水為$\frac{b}{2}$-x,氧氣的量為 $\frac{b}{4}+\frac{x}{2}$,當排出的O2和H2O為等物質的量時,則
$\frac{b}{2}$-x=$\frac{b}{4}+\frac{x}{2}$,x=$\frac{b}{6}$,所以a=$\frac{4b}{6}$,所以$\frac{a}{b}$=$\frac{\frac{4b}{6}}{b}$=$\frac{2}{3}$,故答案為:$\frac{2}{3}$.
點評 本題考查過氧化鈉與水和二氧化碳的反應、氧化還原反應、化學計算等知識點,屬于中等難度試題.


科目:高中化學 來源: 題型:解答題
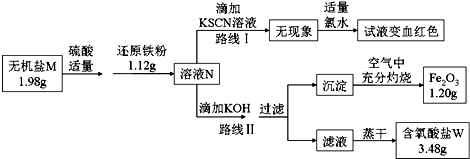
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氟酸不能盛放在玻璃試劑瓶中 | |
| B. | 由沙子制備光伏材料時的反應之一為SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$ Si+2CO↑ | |
| C. | 灼燒NaOH固體時不能使用瓷坩堝,因為坩堝中的SiO2能與NaOH反應 | |
| D. | 玻璃、水晶、陶瓷的主要成分均是硅酸鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
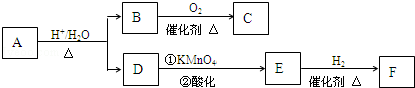
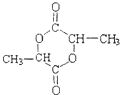 .
.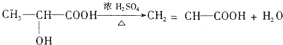 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應物的總能量大于生成物的總能量 | |
| B. | 放熱反應的反應速率總是大于吸熱反應的反應速率 | |
| C. | 應用蓋斯定律,可計算出某些難以直接測量的反應的焓變 | |
| D. | 同溫同壓下,H2(g)+Cl2(g)=2HCl(g)在光照和點燃條件下的△H不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22.4L氯氣用氫氧化鈉溶液充分吸收,反應中轉移了0.5NA個電子 | |
| B. | 標準狀況下分子總數為0.5 NA的H2O與CO2的總體積為11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA個Na+ | |
| D. | 2.3g鈉與足量的水反應產生氫氣的分子數為0.05NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com