
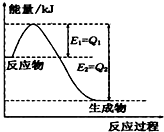
 (1)一定條件下,N2和H2反應生成lmolNH3過程中能量變化如右圖所示,則1mol N2完全反應時的焓變為:
(1)一定條件下,N2和H2反應生成lmolNH3過程中能量變化如右圖所示,則1mol N2完全反應時的焓變為:| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| ||||
|
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
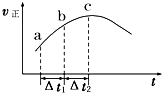 向絕熱恒容密閉容器中通入SO2和NO2,一定條件下使可逆反應SO2(g)+NO2(g)?SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示.由圖可得出正確的結論是( )
向絕熱恒容密閉容器中通入SO2和NO2,一定條件下使可逆反應SO2(g)+NO2(g)?SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示.由圖可得出正確的結論是( )| A、反應在 c 點達到平衡狀態 |
| B、反應物濃度:a 點小于 b 點 |
| C、反應物的總能量低于生成物的總能量 |
| D、△t1=△t2 時,SO2 的轉化率:a~b 段小于 b~c 段 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 如圖是鋰錳電池的反應原理示意圖,其中電解質KClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,得到LiMnO2.回答下列問題:
如圖是鋰錳電池的反應原理示意圖,其中電解質KClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,得到LiMnO2.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 綠礬 |
| H |
| 石灰水 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com