
分析 (1)0.2mol液態肼與足量的液態雙氧水反應,生成氮氣和水蒸氣,放出128.3KJ的熱量,得到①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol,②H2O(g)=H2O(l)△H=-44KJ/mol,根據蓋斯定律來計算焓變書寫方程式;
(2))①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
將方程式2②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)跟怒蓋斯定律來計算△H;
(3)所給反應中轉移12個電子,據此計算每轉移0.3mol電子放出的熱量.
解答 解:(1)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol;
②H2O(g)=H2O(l)△H=-44KJ/mol;
依據蓋斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.5KJ/mol;
化學方程式中32g全部反應放熱817.5KJ,8g液態肼與足量雙氧水反應生成氮氣和液態水時,放出的熱量是204.4,
故答案為:204.4;
(2)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
將方程式2②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案為:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1;
(3)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJ•mol-1,轉移12mol電子放熱1176KJ,則反應過程中,每轉移0.3mol電子放熱29.4kJ,
故答案為:29.4.
點評 本題考查了熱化學方程式的書寫方法和注意問題,蓋斯定律的應用,熱化學方程式的計算,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其中-R為烴基.
,其中-R為烴基.
 ;C的結構簡式
;C的結構簡式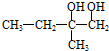 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H2>△H3>2△H1 | B. | △H1>△H2>△H3 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△Hl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
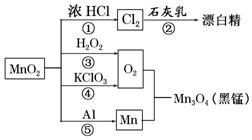
| A. | 只有反應①②④屬于氧化還原反應 | |
| B. | 反應⑤說明該條件下鋁可用于制熔點較高的金屬 | |
| C. | 相同條件下生成等量的O2,反應③和④轉移的電子數之比為1:1 | |
| D. | 反應①中氧化劑與還原劑的物質的量之比為1:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氯及其化合物在生產、生活中有廣泛的用途.回答下列問題:
氯及其化合物在生產、生活中有廣泛的用途.回答下列問題:| 容器編號 | 溫度/ | 容器體積/L | ClO2(g)的平衡轉化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com