
Ⅰ.(1)電鍍時,鍍件與電源的________極連接。
(2)化學鍍的原理是利用化學反應生成金屬單質沉淀在鍍件表面形成鍍層。若用銅鹽進行化學鍍銅,應選用________(填“氧化劑”或“還原劑”)與之反應。
Ⅱ.尿素[CO(NH2)2]是首個由無機物人工合成的有機物。人工腎臟可采用間接電化學方法除去代謝產物中的尿素,原理如圖:
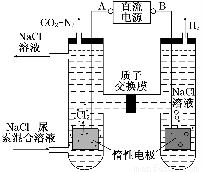
(1)電源的負極為________(填“A”或“B”)。
(2)陽極室中發生的反應依次為________、________。
(3)電解結束后,陰極室溶液的pH與電解前相比將________;若兩極共收集到氣體13.44 L(標準狀況),則除去的尿素為________g(忽略氣體的溶解)。
Ⅰ.(1)負 (2)還原劑
Ⅱ.(1)B (2)2Cl--2e-=Cl2↑ CO(NH2)2+H2O+3Cl2=N2↑+CO2↑+6HCl
(3)不變 7.2
【解析】Ⅰ.(1)電鍍時,鍍層金屬作電解池的陽極,鍍件作電解池的陰極,與電源的負極相連。
(2)鍍銅是將Cu2+變成Cu,需要加入還原劑與之反應。
Ⅱ.(1)圖中產生氫氣的電極為陰極,與陰極相連的電極為負極,所以B為負極。
(2)根據信息,陽極上先產生氯氣,氯氣具有氧化性,尿素中的氮原子為-3價,具有還原性,兩者相遇發生氧化還原反應。
(3)反應過程中實際上發生兩個反應(條件略去):2NaCl+2H2O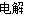 2NaOH+Cl2↑+H2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,兩方程式相加消去中間產物可得總反應方程式:CO(NH2)2+H2O=N2↑+CO2↑+3H2↑,由此可知反應的最終結果是沒有酸或者是堿生成,陰極室的酸堿性不會發生改變;兩極產生的氣體是氫氣、氮氣和二氧化碳,根據化學方程式若設氫氣的量為x,氮氣和二氧化碳各為
2NaOH+Cl2↑+H2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,兩方程式相加消去中間產物可得總反應方程式:CO(NH2)2+H2O=N2↑+CO2↑+3H2↑,由此可知反應的最終結果是沒有酸或者是堿生成,陰極室的酸堿性不會發生改變;兩極產生的氣體是氫氣、氮氣和二氧化碳,根據化學方程式若設氫氣的量為x,氮氣和二氧化碳各為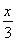 ,則x+
,則x+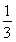 x+
x+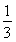 x=
x=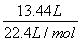 ,解得x=0.36 mol。
,解得x=0.36 mol。
m[CO(NH2)2]=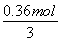 ×60 g·mol-1=7.2 g。
×60 g·mol-1=7.2 g。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
 (2012?福建)(1)電鍍時,鍍件與電源的
(2012?福建)(1)電鍍時,鍍件與電源的查看答案和解析>>
科目:高中化學 來源: 題型:
| A、用玻璃棒蘸取溶液滴到濕潤的pH試紙上,測其pH | B、用惰性電極電解飽和食鹽水時,氫氧化鈉在陽極區生成 | C、電解精煉銅時,粗銅作陽極;電鍍時,鍍層金屬作陰極 | D、用堿式滴定管量取0.10 mol?L-1的Na2CO3溶液22.10mL |
查看答案和解析>>
科目:高中化學 來源:2012年普通高等學校招生全國統一考試理綜化學部分(福建卷帶解析) 題型:填空題
(16分)
(1)電鍍時,鍍件與電源的 極連接。
(2)化學鍍的原理是利用化學反應生成金屬單質沉積在鍍件表面形成鍍層。
① 若用銅鹽進行化學鍍銅,應選用_(填“氧化劑”或“還原劑”)與之反應。
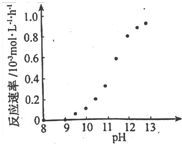
② 某化學鍍銅的反應速率隨鍍液pH 變化如右圖所示。該鍍銅過程中,鍍液pH 控制在12.5左右。據圖中信息,給出使反應停止的方法: 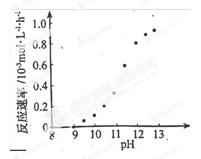
(3)酸浸法制取硫酸銅的流程示意圖如下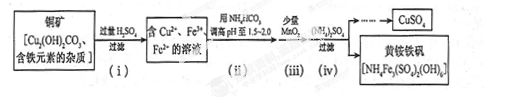
① 步驟(i)中Cu2(OH) 2CO3發生反應的化學方程式為 。
② 步驟(ii)所加試劑起調節pH 作用的離子是 (填離子符號)。
③ 在步驟(iii)發生的反應中,1 mol MnO2轉移2 mol 電子,該反應的離子方程式為 。
④ 步驟(iv)除去雜質的化學方程式可表示為
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
過濾后母液的pH =" 2.0" , c (Fe3+) ="a" mol·L-1,, c ( NH4+)="b" mol·L-1,, c ( SO42-)=" d" mol·L-1,該反應的平衡常數K=_ (用含a 、b 、d 的代數式表示)。
查看答案和解析>>
科目:高中化學 來源:2012年福建省高考化學試卷(解析版) 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com