
 ,
, ;離子鍵、共價鍵
;離子鍵、共價鍵| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-11 |


科目:高中化學 來源: 題型:
| ||
| △ |
| 化學鍵 | H-Cl | O=O | Cl=Cl | H-O |
| 鍵能/kJ.mol-1 | 431 | 498 | 243 | 463 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、金屬元素的原子最外層電子數越少,則該元素的金屬性越強 |
| B、同周期元素原子半徑和離子半徑從左到右均依次減小 |
| C、第三周期非金屬氧化物對應水化物的酸性從左到右依次增強 |
| D、第ⅦA族元素氣態氫化物的還原性從上到下依次增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:
A、硝基苯的結構簡式: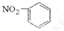 | ||
B、NH4Cl的電子式: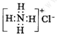 | ||
C、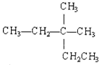 的名稱為:3,3二甲基戍烷 的名稱為:3,3二甲基戍烷 | ||
D、具有16個質子、16個種子和18個電子的微粒一定是
|
查看答案和解析>>
科目:高中化學 來源: 題型:
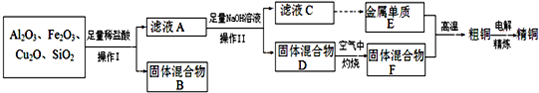
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
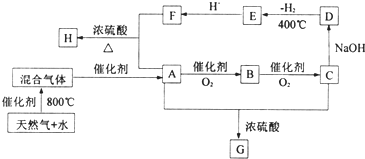
查看答案和解析>>
科目:高中化學 來源: 題型:
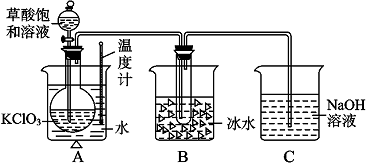
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量沉淀于試管中,加入加入足量0.1mol?L-1 CH3COOH. | |
| 步驟2: |
查看答案和解析>>
科目:高中化學 來源: 題型:
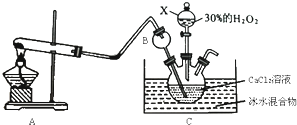
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com