
| A. | 6.8 g熔融的KHSO4中含有0.05NA個陽離子 | |
| B. | 1.0 L 2 mol/L的NaOH(aq)中含有的氧原子數目為2NA | |
| C. | 在24 g18O2中含有1.5NA個氧原子 | |
| D. | 在反應KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2轉移的電子數為6NA |
分析 A、熔融硫酸氫鉀電離出鉀離子和硫酸氫根離子;
B、氫氧化鈉水溶液中,溶劑水中同樣含有氧原子;
C、依據n=$\frac{m}{M}$計算物質的量結合分子式計算原子數;
D、I元素的化合價由+5價降低為0,I元素的化合價由-1價升高為0,轉移5e-.
解答 解:A、6.8g熔融的KHSO4的物質的量0.05mol,0.05mol熔融硫酸氫鉀能夠電離出0.05mol鉀離子和0.05mol硫酸氫根離子,所以含有的陽離子數為0.05NA,故A正確;
B、1.0L 2mol/L的NaOH水溶液中含有溶質氫氧化鈉2mol,由于溶劑水中也含有氧原子,所以無法計算溶液中含有的氧原子的物質的量及數目,故B錯誤;
C、依據n=$\frac{m}{M}$計算物質的量=$\frac{24g}{36g/mol}$=$\frac{2}{3}$mol,結合分子式計算原子數含有2×$\frac{2}{3}$NA個氧原子,故C錯誤;
D、在反應KIO3+6HI=KI+3I2+3H2O中,I元素的化合價由+5價降低為0,I元素的化合價由-1價升高為0,生成3mo1I2轉移的電子數為5NA,故D錯誤.
故選A.
點評 本題考查阿伏加德羅常數的有關計算和判斷,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,題有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
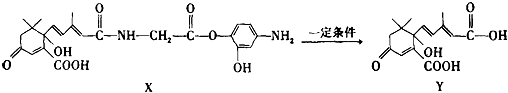
| A. | X可以發生氧化、取代、酯化、加聚、縮聚反應,并能與鹽酸反應生成有機鹽 | |
| B. | Y既可以與FeCl3溶液發生顯色反應,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X與足量NaOH溶液反應,最多消耗4mol NaOH | |
| D. | X結構中有2個手性碳原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第二周期元素氫化物穩定性順序是HF>H2O>NH3;則第三周期元素氫化物穩定性順序也是HCl>H2S>PH3 | |
| B. | SiO2晶體熔化時破壞的是共價鍵;所以CO2晶體熔化時破壞的也是共價鍵 | |
| C. | 可電解熔融MgCl2來制取金屬鎂;也能電解熔融AlCl3來制取金屬鋁 | |
| D. | 晶體中有陰離子,必有陽離子;則晶體中有陽離子,也必有陰離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液盛裝在用橡膠塞的試劑瓶中 | |
| B. | 氫氟酸盛裝在細口玻璃瓶中 | |
| C. | 硫酸亞鐵溶液存放在加有少量鐵粉的試劑瓶中 | |
| D. | 金屬鈉保存在石蠟油或煤油中 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
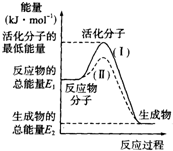 (1)在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子被稱為活化分子.使普通分子變成活化分子所需要提供的最低限度的能量叫活化能,其單位通常用kJ•mol-1表示.請認真觀察下圖,然后回答問題.
(1)在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子被稱為活化分子.使普通分子變成活化分子所需要提供的最低限度的能量叫活化能,其單位通常用kJ•mol-1表示.請認真觀察下圖,然后回答問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com