
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤⑥ | B. | ②③ | C. | ②③⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Mg2+、MnO4-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | K+、Na+、AlO2-、NO3- | D. | Mg2+、K+、HCO3-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它們的最高價氧化物的相應水化物的堿性依次減弱,酸性依次增強 | |
| B. | 它們的原子半徑依次增大 | |
| C. | 它們的單質在常溫.常壓下的密度依次減小 | |
| D. | 它們的最高價氧化物的水化物都是強電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
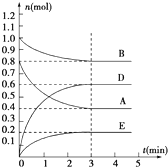 在容積為2L的密閉容器內,T℃時發生反應:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q為最簡比例的整數)反應過程如圖所示:
在容積為2L的密閉容器內,T℃時發生反應:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q為最簡比例的整數)反應過程如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
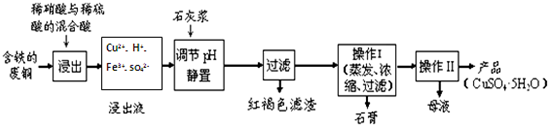
| 溫度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 膽礬 | 32 | 44.6 | 61.8 | 83.8 | 114 |
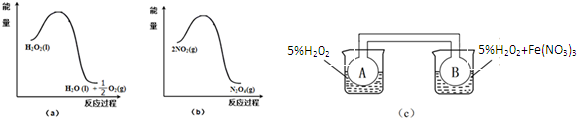
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com