
 A、B、C、D為原子序數依次增大的四種元素,A2-和B+具有相同的電子構型;C、D為同周期元素,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子.回答下列問題:
A、B、C、D為原子序數依次增大的四種元素,A2-和B+具有相同的電子構型;C、D為同周期元素,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子.回答下列問題:分析 C核外電子總數是最外層電子數的3倍,應為P元素,C、D為同周期元素,則應為第三周期元素,D元素最外層有一個未成對電子,應為Cl元素,A2-和B+具有相同的電子構型,結合原子序數關系可知A為O元素,B為Na元素.
(1)同周期自左而右電負性增大,Cl元素氧化物中氧元素表現負價,四種元素電負性最大的為O元素;C為P元素,原子核外電子數為15,根據能量最低原理原理書寫核外電子排布式;
(2)A為O元素,有O2、O3兩種同素異形體,均屬于分子晶體,相對原子質量越大,沸點越高;
A、B的氫化物分別為H2O、NaH,前者為分子晶體、后者為離子晶體;
(3)C和D生成組成比為1:3的化合物E為PCl3,計算P原子價層電子對數、孤電子對數,確定雜化方式與空間構型;
(4)化合物D2A為Cl2O,氯氣與濕潤的Na2CO3反應得到Cl2O,由電子轉移守恒可知,先得到HCl生成,HCl再與碳酸鈉反應;
(5)A和B能夠形成化合物F為離子化合物,陰離子位于晶胞的定點和面心,陽離子位于晶胞的體心,則Na的個數為8,O的個數為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,則形成的化合物為Na2O,由晶胞結構可知B原子配位數為4,結合化學式可以計算A原子配位數,計算質量和體積,可計算密度.
解答 解:C核外電子總數是最外層電子數的3倍,應為P元素,C、D為同周期元素,則應為第三周期元素,D元素最外層有一個未成對電子,應為Cl元素,A2-和B+具有相同的電子構型,結合原子序數關系可知A為O元素,B為Na元素.
(1)同周期自左而右電負性增大,Cl元素氧化物中氧元素表現負價,四種元素電負性最大的為O元素;C為P元素,原子核外電子數為15,根據能量最低原理原理,核外電子排布式為:1s22s22p63s23p3,
故答案為:O;1s22s22p63s23p3;
(2)A為O元素,有O2、O3兩種同素異形體,二者對應的晶體都為分子晶體,因O3相對原子質量較大,則范德華力較大,沸點較高,A的氫化物為H2O,屬于分子晶體,B的氫化物為NaH,屬于離子晶體,
故答案為:O3;O3相對原子質量較大,范德華力較大;分子晶體;離子晶體
(3)C和D生成組成比為1:3的化合物E為PCl3,P形成3個δ鍵,孤電子對數為$\frac{5-1×3}{2}$=1,則為sp3雜化,立體構型為為三角錐形,
故答案為:三角錐形;sp3;
(4)化合物D2A為Cl2O,氯氣與濕潤的Na2CO3反應得到Cl2O,由電子轉移守恒可知,先得到HCl生成,HCl再與碳酸鈉反應,反應的方程式為:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl),
故答案為:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl);
(5)A和B能夠形成化合物F為離子化合物,陰離子位于晶胞的定點和面心,陽離子位于晶胞的體心,則Na的個數為8,O的個數為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,則形成的化合物為Na2O;
由晶胞結構可知B(O)原子配位數為4,結合化學式可知A(Na)原子配位數為4×2=8;
晶胞的質量為$\frac{4×62g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$,晶胞的體積為(0.566×10-7)cm3,則晶體F的密度為$\frac{4×62g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$÷(0.566×10-7)cm3=2.27g•cm-3,
故答案為:Na2O;8;2.27g•cm-3.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、沸點比較、雜化方式與空間構型判斷、化學方程式書寫、晶胞計算等,側重考查學生的分析能力、計算能力,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F六種物質的轉化關系如圖所示(反應條件和部分產物未標出)
A、B、C、D、E、F六種物質的轉化關系如圖所示(反應條件和部分產物未標出)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬凈水過程中不涉及化學變化 | |
| B. | 由同種元素組成的物質一定是純凈物 | |
| C. | 風化、石油分餾和碘的升華都是物理變化 | |
| D. | 為除去蛋白質溶液中少量的NaCl,可以利用滲析的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
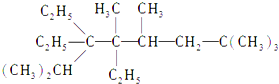 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現有A、B、C、D、E五種短周期元素,已知:①元素的原子序數按A、B、C、D、E依次增大,原子半徑按D、E、B、C、A順序依次減小;②A、D同主族,A是所有元素中原子半徑最小的元素;③通常狀況下,A2、B2、C2三種單質均為常見無色氣體;④B、D、E三者的最高價氧化物對應的水化物依次為甲、乙、丙,它們兩兩之間均可反應生成可溶性鹽和水,且所得鹽中均含C元素.請填寫下列空白:
現有A、B、C、D、E五種短周期元素,已知:①元素的原子序數按A、B、C、D、E依次增大,原子半徑按D、E、B、C、A順序依次減小;②A、D同主族,A是所有元素中原子半徑最小的元素;③通常狀況下,A2、B2、C2三種單質均為常見無色氣體;④B、D、E三者的最高價氧化物對應的水化物依次為甲、乙、丙,它們兩兩之間均可反應生成可溶性鹽和水,且所得鹽中均含C元素.請填寫下列空白:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com