
【題目】短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍。
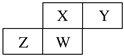
請回答下列問題:
(1)Z位于周期表中的位置______________。
(2)X、Y元素的氫化物中,較穩定性的是________(填化學式)。
(3)X的氣態氫化物與其最高價氧化物對應的水化物反應生成的化合物中存在的化學鍵類型為_________。
(4)請寫出X的最高價氧化物對應水化物的稀溶液與少量鐵粉反應的離子反應方程式:______________。
【答案】 第三周期第ⅣA族 H2O 離子鍵、共價鍵 Fe+4H++NO3-=Fe3++NO↑+2H2O
【解析】分析:短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍,W位于第三周期,則W是P,所以X是N,Y是O,Z是Si,結合元素周期律解答。
詳解:根據以上分析可知X是N,Y是O,Z是Si,W是P。則
(1)Z是Si,位于周期表中的位置為第三周期第ⅣA族。
(2)非金屬性越強,氫化物越穩定。非金屬性是O>N,則X、Y元素的氫化物中,較穩定性的是H2O。
(3)X的氣態氫化物氨氣與其最高價氧化物對應的水化物硝酸反應生成的化合物是硝酸銨,其中存在的化學鍵類型為離子鍵、共價鍵。
(4)X的最高價氧化物對應水化物的稀溶液是稀硝酸,與少量鐵粉反應的離子反應方程式為Fe+4H++NO3-=Fe3++NO↑+2H2O。


科目:高中化學 來源: 題型:
【題目】“酒是陳的香”就是因為酒在貯存過程中生成了有香味的乙酸乙酯。在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯。回答下列問題。

(1)乙烯制取乙醇的化學方程式:__________________________。
(2)寫出制取乙酸乙酯的化學反應方程式:________________________。
(3)濃硫酸的作用:_______________________________。
(4)飽和碳酸鈉溶液的主要作用是________________________________________。
(5)裝置中導管要在飽和碳酸鈉溶液的液面上,不能插入溶液中,目的是__________。
(6)若要把制得的乙酸乙酯分離出來,應該采用的實驗操作是___________________。
(7)做此實驗時,有時還要向盛有乙酸乙酯的試管里加入幾塊碎瓷片,其目的是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X﹑Y﹑Z﹑W﹑Q的原子序數逐漸增大。X原子核外最外層電子數是次外層電子數的2倍。Y的氟化物YF3分子中各原子均滿足最外層8電子穩定結構。Z﹑W是常見金屬,Z是同周期中原子半徑最大的元素。W的簡單離子是同周期中離子半徑最小的。X和Z原子序數之和與Q的原子序數相等。下列說法正確的是
A. 相同質量的Z和W單質分別與足量稀鹽酸反應時,Z的單質獲得的氫氣多
B. X與Q形成的化合物和Z與Q形成的化合物的化學鍵類型相同
C. 最高價氧化物對應的水化物的酸性:X<W
D. Y的簡單氣態氫化物與Q的單質反應,現象是產生白煙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制備Cl2并通入FeCl2溶液中獲得FeCl3溶液的部分裝置。
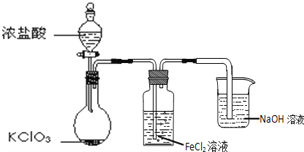
(1)NaOH溶液的作用是______。
(2)實驗中,需控制氯氣產生的速度,以便使FeCl2溶液轉化完全。控制生成氯氣速度的操作是______。
(3)開始反應后,在洗氣瓶和燒杯所盛放的物質中,被氧化的是______(填化學式)。
(4)燒瓶中發生反應的化學方程式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應發生在同種元素之間的是( )
A. Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
B. 2H2S+SO2![]() 3S↓+2H2O
3S↓+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學研究性學習小組欲設計實驗驗證Zn、Fe、Cu的金屬活動性,他們提出了以下兩種方案.請你幫助他們完成有關實驗項目:
(1)用三種金屬與鹽酸反應的現象來判斷,實驗中除選擇大小相同的金屬片外,還需要控制________、________相同;若選用一種鹽溶液驗證三種金屬的活潑性,該試劑________.
(2)①若用Zn、Cu作電極設計成原電池,并能產生持續穩定的電流,以確定Zn、Cu的活動性.試在下面方框中畫出原電池裝置圖,標出原電池的電極材料和電解質溶液_______.

②上述裝置中正極反應式為 ________.
③某小組同學采用Zn、Fe作為電極,只用一個原電池證明三種金屬的活動性,則電解質溶液最好選用________.
A.0.5molL﹣1氯化亞鐵溶液
B.0.5molL﹣1氯化銅溶液
C.0.5molL﹣1鹽酸
D.0.5molL﹣1氯化亞鐵和0.5molL﹣1氯化銅混合溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化合物由碳、氫、氧三種元素組成,其紅外光譜圖只有C—H鍵、O—H鍵、C—O鍵的振動吸收,該有機物的相對分子質量是60,則該有機物的結構簡式是
A. CH3CH2OCH3 B. CH3CH(OH)CH3 C. CH3CH2CH2CH2OH D. CH3COOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com