
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL) | 50 | 150 | 300 | 380 | 410 |
分析 (1)影響化學反應速率的因素有濃度、溫度以及固體的表面積大小等因素,溫度越高、濃度越大、固體表面積越大,反應的速率越大,從表中數據看出2 min~3 min收集的氫氣比其他時間段多,原因是Zn置換H2的反應是放熱反應,溫度升高;4 min~5 min收集的氫氣最少是因為隨反應進行c(H+)下降;
(2)影響反應速率的因素:濃度、原電池原理、溫度、壓強等,據此回答判斷;
(3)根據原子最外層電子數和化合價判斷,在化合物中,原子最外層電子數等于原子的價層電子數+|化合價|,以此進行分析.
解答 解:(1)①0~1、l~2、2~3、3~4、4~5min各時間段生成氫氣的體積分別為50、150、300、380、410,可以看出反應速率最大的是2~3min,鋅與稀硫酸反應為放熱反應,隨反應的進行,溫度越來越高,反應速率加快,
故答案為:2~3min;因該反應是放熱反應,此時溫度高;
②4 min~5 min收集的氫氣最少是因為隨反應進行c(H+)下降,反應物濃度越低,反應速率越小,
故答案為:4~5 min,此時H+濃度小;
(2)為了減慢反應速率,可以降低反應溫度、減低反應物的濃度,加入蒸餾水可以擴大酸溶液的體積而降低其濃度,加入硝酸鈉溶液時,存在的硝酸根離子和氫離子相當于存在硝酸,金屬鋁和硝酸反應不會產生氫氣,當加入少量CuCl2晶體時,CuCl2會與鋅反應置換出銅,Al、銅與酸會形成原電池,發生原電池反應而加快反應速率,
故答案為:A;BC;加入少量CuCl2晶體時,CuCl2會與鋅反應置換出銅,Al、銅與酸會形成原電池,發生原電池反應而加快反應速率;加入硝酸鈉溶液時,存在的硝酸根離子和氫離子相當于存在硝酸,金屬鋁和硝酸反應不會產生氫氣;
(3)根據原子最外層電子數和化合價判斷,在化合物中,原子最外層電子數等于原子的價層電子數+|化合價|,
①H2O中的H原子不滿足最外層為8電子結構,故錯誤;
②BF3B原不滿足最外層為8電子結構,故錯誤;
③CCl4原子都滿足最外層為8電子結構,故正確;
④PCl3原子都滿足最外層為8電子結構,故正確;
⑤SO3S原子不滿足最外層為8電子結構,故錯誤;
⑥N2滿足最外層為8電子結構,故正確;
⑦CO2原子都滿足最外層為8電子結構,故正確;
故答案為:③④⑥⑦.
點評 本題考查化學反應速率的影響因素,題目難度不大,注意判斷是否滿足8電子結構的方法,注意利用化合價與最外層電子數來分析即可解答,注重基礎知識的積累.


科目:高中化學 來源: 題型:解答題
| 反應 | 大氣固氮N2(g)+O2(g)?2NO(g) | |
| 溫度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L NH3溶于水后溶液中含有NA個NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA個Na+ | |
| C. | 1 mol 硫酸鉀中陰離子所帶電荷數為NA | |
| D. | 將0.1mol氯化鐵溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaH在水中顯堿性 | |
| B. | NaH中氫離子電子層排布與氦原子相同 | |
| C. | NaH中氫離子半徑比鋰離子半徑大 | |
| D. | NaH中氫離子被還原為H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大反應物濃度,可增大單位體積內活化分子的百分數,從而使有效碰撞次數增多 | |
| B. | 有氣體參加的反應,若增大壓強,可增大活化分子的百分數,從而使反應速率增大 | |
| C. | 升高溫度能使反應速率增大的主要原因是減小了反應物分子中活化分子的百分數 | |
| D. | 催化劑能增大活化分子的百分數,從而成千上萬倍地增大反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
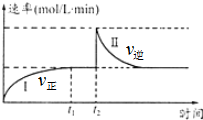 在一定恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)?2C(g)△H<0.t1時刻達到平衡后,在t2時刻改變某一條件達新平衡,其反應過程如圖.下列說法中錯誤的是(
在一定恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)?2C(g)△H<0.t1時刻達到平衡后,在t2時刻改變某一條件達新平衡,其反應過程如圖.下列說法中錯誤的是(| A. | 0~t2時,v正>v逆 | |
| B. | t2時刻改變的條件可能是加催化劑 | |
| C. | Ⅰ、Ⅱ兩過程達到平衡時,A的體積分數Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ兩過程達到平衡時,平衡常數I<Ⅱ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X、Y、Z、W 元素的離子半徑依次減小 | |
| B. | W 的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點 | |
| C. | 若W 與Y的原子序數相差5,則二者形成的化合物的化學式可能為Y2W3或Y3W2 | |
| D. | W 與X形成的化合物只含離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | R原子最外層電子數為5 | B. | 單質的氧化性:甲<乙 | ||
| C. | 原子半徑:R>Z | D. | HRO3與HZ計量數之比為1:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑的大小順序:r(X)>r(Y)>r(Z) | |
| B. | 氣態氫化物的熱穩定性:X>Y | |
| C. | 元素X的最高價氧化物對應的水化物是強酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化學鍵的類型相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com