
 ;
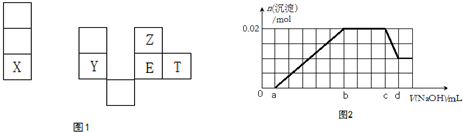
;分析 X是短周期中原子半徑最大的元素是鈉元素; X、Y在同一周期,Y是常見的半導體材料所以Y是硅元素; E的最高價氧化物對應水化物有強脫水性,所以E是硫元素,則T是氯元素,Z是氧元素;
(1)氯元素三個電子層,最外層7個電子;
(2)這幾種元素的氫化物中,水溶液酸性最強的是鹽酸,SiO2是原子晶體,而二氧化硫是分子晶體,二氧化硅熔點高于SO2的熔點;
(3)E2T2的化學式為:S2Cl2,電子式為: ;
;
(4)工業上是電解熔融的氯化鈉制備單質鈉的;
(5)已知1mol晶體硅在足量氧氣中燃燒,恢復至室溫,放出989.2kJ 熱量,所以熱化學方程式為:Si(s)+O2(g)═SiO2(s)△H=-989.2 kJ•mol-1;
(6)①通過圖象知,在加入過量的過氧化鈉的過程中,一開始就有沉淀生成,說明不含有H+,沉淀部分溶解,推斷一定含有Al3+;圖象中有一段平臺,說明加入OH-時無沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,說明溶液中含Mg2+;原溶液確定含有Mg2+、Al3+、NH4+,由圖可知,沉淀最大時是氫氧化鎂、氫氧化鋁沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小時,為氫氧化鎂,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根據鋁元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根據Al(OH)3+OH-=AlO2-+2H2O,需OH-0.01mol;由圖可知消耗Na0H(d-c)mL,所以c(Na0H )=$\frac{n}{V}$,由此分析解答;
②原溶液確定含有Mg2+、Al3+、NH4+,由圖可知,沉淀最大時是氫氧化鎂、氫氧化鋁沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小時,為氫氧化鎂,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根據鋁元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根據Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根據鎂元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,由(2)知而c到d一格氫氧根離子的濃度為0.01mol,0→a與氫離子反應,所以氫離子的物質的量為0.01mol,由此求原溶液確定含有Mg2+、Al3+、H+,其物質的量之比.
解答 解:X是短周期中原子半徑最大的元素是鈉元素; X、Y在同一周期,Y是常見的半導體材料所以Y是硅元素; E的最高價氧化物對應水化物有強脫水性,所以E是硫元素,則T是氯元素,Z是氧元素;
(1)氯元素三個電子層,最外層7個電子,所以T在元素周期表中的位置是第三周期,第ⅦA族,故答案為:第三周期,第ⅦA族;
(2)這幾種元素的氫化物中,水溶液酸性最強的是鹽酸,SiO2是原子晶體,而二氧化硫是分子晶體,二氧化硅熔點高于SO2的熔點,故答案為:HCl;高于;
(3)E2T2的化學式為:S2Cl2,電子式為: ,故答案為:
,故答案為: ;
;
(4)工業上是電解熔融的氯化鈉制備單質鈉的,化學反應方程式2NaCl$\frac{\underline{\;電解\;}}{\;}$2Na+Cl2↑,故答案為:2NaCl$\frac{\underline{\;電解\;}}{\;}$2Na+Cl2↑;
(5)已知1mol晶體硅在足量氧氣中燃燒,恢復至室溫,放出989.2kJ 熱量,所以熱化學方程式為:Si(s)+O2(g)═SiO2(s)△H=-989.2 kJ•mol-1,故答案為:Si(s)+O2(g)═SiO2(s)△H=-989.2 kJ•mol-1;
(6)①通過圖象知,在加入過量的過氧化鈉的過程中,一開始就有沉淀生成,說明不含有H+,沉淀部分溶解,推斷一定含有Al3+;圖象中有一段平臺,說明加入OH-時無沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,說明溶液中含Mg2+,所以NaOH溶液滴至b~c段過程中發生的離子反應方程式為NH4++OH-=NH3•H2O,原溶液確定含有Mg2+、Al3+、NH4+,由圖可知,沉淀最大時是氫氧化鎂、氫氧化鋁沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小時,為氫氧化鎂,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根據鋁元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根據Al(OH)3+OH-=AlO2-+2H2O,需OH-0.01mol;由圖可知消耗Na0H(d-c)mL,所以c(Na0H )=$\frac{n}{V}$=$\frac{0.01}{(d-c)×0.001}$=$\frac{10}{d-c}$mol•L-1,故答案為:NH4++OH-=NH3•H2O;$\frac{10}{d-c}$ mol•L-1;
②原溶液確定含有Mg2+、Al3+、NH4+,由圖可知,沉淀最大時是氫氧化鎂、氫氧化鋁沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小時,為氫氧化鎂,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根據鋁元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根據Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根據鎂元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,由(2)知而c到d一格氫氧根離子的濃度為0.01mol,0→a與氫離子反應,所以氫離子的物質的量為0.01mol,則n(Mg2+):n(Al3+):n(H+)為1:1:1,故答案為:1:1:1.
點評 本題考查結構性質位置關系、常用化學用語、元素化合物性質等,推斷元素是解題,定性分析離子共存、定量分析離子的物質的量是解題的關鍵,注意基礎知識的理解掌,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 單質的還原性:W>X>Y | |
| B. | 原子半徑:X>Y>Z>W | |
| C. | X的最高價氧化物對應水化物的堿性比Y的弱 | |
| D. | 化合物XYW4具有強氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
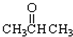 ③CH3CH2Br ④
③CH3CH2Br ④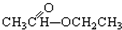 ⑤
⑤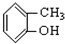 ⑥
⑥ ⑦
⑦ ⑧
⑧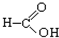 ⑨
⑨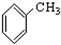 ⑩
⑩
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W、M的離子半徑及最高價氧化物對應水化物的堿性皆為M<W | |
| B. | YZ2為直線型的共價化合物,W2Z2既含有離子鍵又含有共價鍵 | |
| C. | Y與X形成的化合物的熔沸點一定低于Z與X形成的化合物的熔沸點 | |
| D. | Z與M形成的化合物可作為耐高溫材料,W、M、X以1:1:4組成的化合物是應用前景很廣泛的儲氫材料,具有很強的還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶中原有少量蒸餾水 | |
| B. | 定容時觀察液面俯視 | |
| C. | 滴管加水時,有少量水滴到容量瓶外 | |
| D. | 溶液從燒杯轉移到容量瓶中后沒有洗滌燒杯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑥ | B. | ③ | C. | ②⑤ | D. | ①④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com