
【題目】芳香酯類化合物A、B互為同分異構體,均含C、H、O三種元素。相同狀況下,A、B蒸氣對氫氣的相對密度是97,分子中C、H原子個數相同,且C、H原子個數之和是氧原子數的5倍。已知:各有機物間存在如下轉化關系:
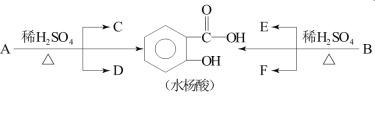
其中C能發生銀鏡反應,F經連續氧化可生成C;C與D是相對分子質量相同的不同類有機物。
(1)A的分子式是________。
(2)E中所含官能團的名稱是________;完全燃燒時,1 mol D與1 mol下列________的耗氧量相同(填字母代號)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)寫出水楊酸與小蘇打反應的化學方程式是___________;寫出C與F反應的化學方程式是_________。
(4)同時符合下列要求的同分異構體有___________種。
①與A互為同分異構體;
②能發生水解反應;
③苯環上有兩個取代基,且苯環上的一氯代物只有1種。
(5)1 mol 上述(4)中的一種有機物X,能與4 mol NaOH發生反應,寫出此反應的化學方程式__________
【答案】C10H10O4 羧基 ac 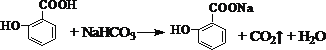 CH3OH+HCOOH
CH3OH+HCOOH ![]() HCOOCH3+H2O 3
HCOOCH3+H2O 3 ![]() +4NaOH
+4NaOH![]() 2CH3COONa+
2CH3COONa+![]() +2H2O
+2H2O
【解析】
A、B蒸氣對氫氣的相對密度是97,則相對分子質量為194,分子中C、H原子個數相同,且C、H原子總數是氧原子數的5倍,設C原子數為n,則H原子數為n,O原子數為![]() ,則12n+n+
,則12n+n+![]() ×16=194,n=10,分子式為C10H10O4,C能發生銀鏡反應,應含有醛基,F經連續氧化可生成C,說明F為醇,C為酸且含有醛基,應為HCOOH,則F為CH3OH;C與D是相對分子質量相同的不同類有機物,則D應為CH3CH2OH,由此可知A為
×16=194,n=10,分子式為C10H10O4,C能發生銀鏡反應,應含有醛基,F經連續氧化可生成C,說明F為醇,C為酸且含有醛基,應為HCOOH,則F為CH3OH;C與D是相對分子質量相同的不同類有機物,則D應為CH3CH2OH,由此可知A為![]() ,E為CH3COOH,B為
,E為CH3COOH,B為![]() ,據此分析。
,據此分析。
A、B蒸氣對氫氣的相對密度是97,則相對分子質量為194,分子中C、H原子個數相同,且C、H原子總數是氧原子數的5倍,設C原子數為n,則H原子數為n,O原子數為![]() ,則12n+n+
,則12n+n+![]() ×16=194,n=10,分子式為C10H10O4,C能發生銀鏡反應,應含有醛基,F經連續氧化可生成C,說明F為醇,C為酸且含有醛基,應為HCOOH,則F為CH3OH;C與D是相對分子質量相同的不同類有機物,則D應為CH3CH2OH,由此可知A為
×16=194,n=10,分子式為C10H10O4,C能發生銀鏡反應,應含有醛基,F經連續氧化可生成C,說明F為醇,C為酸且含有醛基,應為HCOOH,則F為CH3OH;C與D是相對分子質量相同的不同類有機物,則D應為CH3CH2OH,由此可知A為![]() ,E為CH3COOH,B為
,E為CH3COOH,B為![]() 。
。
(1)由以上分析可知A的分子式為C10H10O4;
(2)E為CH3COOH,所含官能團的名稱是羧基;
D為CH3CH2OH,1molCH3CH2OH完全燃燒消耗(2+![]() -
-![]() )mol=3mol氧氣,
)mol=3mol氧氣,
a消耗氧氣為3+![]() -
-![]() =3mol,b消耗氧氣為3+
=3mol,b消耗氧氣為3+![]() -
-![]() =4.5mol,c消耗氧氣為2+
=4.5mol,c消耗氧氣為2+![]() =3mol,d消耗氧氣為2+
=3mol,d消耗氧氣為2+![]() -
-![]() =2.5mol,
=2.5mol,
答案選ac;
(3)水楊酸含有-COOH,可與碳酸氫鈉反應,但酚羥基不反應,則反應的方程式為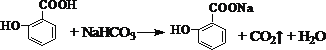 ;
;
C為HCOOH,F為CH3OH,二者可發生酯化反應,反應的方程式為CH3OH+HCOOH ![]() HCOOCH3+H2O;
HCOOCH3+H2O;
(4)A為![]() ,對應的同分異構體能水解,說明含有酯基,苯環上有兩個取代基,且苯環上的一氯代物只有1種,說明取代基相同,且位于對位,可能的同分異構體有
,對應的同分異構體能水解,說明含有酯基,苯環上有兩個取代基,且苯環上的一氯代物只有1種,說明取代基相同,且位于對位,可能的同分異構體有![]() 、
、![]() 、
、![]() 共3種;
共3種;
(5)1 mol 上述(4)中的一種有機物X,能與4 mol NaOH發生反應,則X為![]() ,此反應的化學方程式為
,此反應的化學方程式為![]() +4NaOH
+4NaOH![]() 2CH3COONa+
2CH3COONa+![]() +2H2O。
+2H2O。


 世紀百通主體課堂小學課時同步達標系列答案
世紀百通主體課堂小學課時同步達標系列答案 世紀百通優練測系列答案
世紀百通優練測系列答案 百分學生作業本題練王系列答案
百分學生作業本題練王系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列有關敘述正確的是
A.標準狀況下,22.4 L CH2Cl2中含有碳原子數為NA
B.在溶有1molFe(OH)3的膠體中含有的膠粒數小于NA
C.常溫下0.2 mol鋁與足量濃硫酸反應,生成氣體的分子數為0.3 NA
D.常溫下向密閉容器內充入46 g NO2,容器中氣體的分子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在![]() 時,碳酸鈣在水中的沉淀溶解平衡曲線如圖所示,已知
時,碳酸鈣在水中的沉淀溶解平衡曲線如圖所示,已知![]() 時硫酸鈣的Ksp=9.1×10-6,下列說法正確的是( )
時硫酸鈣的Ksp=9.1×10-6,下列說法正確的是( )
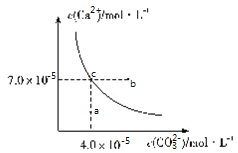
A.除去鍋爐水垢中硫酸鈣的辦法是將其轉化為碳酸鈣,然后用酸去除
B.圖中b點碳酸鈣的結晶速率小于其溶解速率
C.通過蒸發,可使溶液由a點變化到c點
D.在25℃時,反應![]() 的平衡常數K=3500
的平衡常數K=3500
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溶液中的化學反應大多是離子反應。根據要求回答下列問題:
(1)鹽堿地(含較多Na2CO3、NaCl)不利于植物生長,試用化學方程式表示:鹽堿地產生堿性的原因:______________;農業上用石膏降低其堿性的反應原理:__________。
(2)若取pH、體積均相等的NaOH溶液和氨水分別用水稀釋m倍、n倍,稀釋后pH仍相等,則m________(填“>”“<”或“=”)n。
(3)常溫下,在pH=6的CH3COOH與CH3COONa的混合溶液中水電離出來的c(OH-)=__________。
(4)25 ℃時,將a mol·L-1氨水與0.01 mol·L-1鹽酸等體積混合,反應平衡時溶液中c(![]() )=c(Cl-),則溶液顯________(填“酸”“堿”或“中”)性。用含a的代數式表示NH3·H2O的電離常數Kb=________。
)=c(Cl-),則溶液顯________(填“酸”“堿”或“中”)性。用含a的代數式表示NH3·H2O的電離常數Kb=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】表是25℃時某些鹽的溶度積常數和弱酸的電離平衡常數,下列說法正確的是
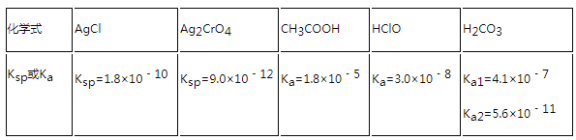
A.相同濃度CH3COONa和NaClO的混合溶液中,各種離子濃度的大小關系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.次氯酸鈉溶液中通入少量CO2的離子方程式為:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1 molL﹣1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO﹣)=5:9,此時溶液的pH=5
D.向濃度均為1.0×10﹣3molL﹣1的KCl和K2CrO4混合溶液中滴加1.0×10﹣3molL﹣1的AgNO3溶液,CrO42﹣先形成沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,下列五種溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
請根據要求填寫下列空白:
(1)溶液①呈_____性(填“酸”、“堿”或“中”),其原因是________(用離子方程式表示)。
(2)比較②③溶液中,c(NH4+)的大小關系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 離子的濃度為0.1mol/L;NH3H2O和_____離子的物質的量濃度之和為0.2mol/L。
(4)室溫下,測得溶液②的pH=7,則CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-與NH4+濃度的大小關系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
①常溫下,強酸溶液的pH=a,將溶液的體積稀釋到原來10n倍,則pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③將0.1molL﹣1的NaHS和0.1molL﹣1Na2S溶液等體積混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氨水中滴加0.1mol/L鹽酸,剛好完全中和時pH=a,則由水電離產生的c(H+)=10﹣a molL﹣1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應(均未配平)中,氧化劑與還原劑物質的量的關系為1∶2的是
A.Cu+H2SO4![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
B.CH3COOH+Ca(ClO)2![]() HClO+Ca(CH3COO)2
HClO+Ca(CH3COO)2
C.I2+NaClO3![]() NaIO3+Cl2
NaIO3+Cl2
D.HCl+MnO2![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活相互滲透,下列說法中不正確的是![]()
A.臭氧![]() 生物活性炭用于自來水深度處理,利用了臭氧的強氧化性和活性炭的吸附性。
生物活性炭用于自來水深度處理,利用了臭氧的強氧化性和活性炭的吸附性。
B.華為自主研發的“麒麟”芯片與光導纖維是同種材料。
C.采取“靜電除塵”、“燃煤煙氣脫硫”、“汽車尾氣催化凈化”等方法可提高空氣質量。
D.![]() 天工開物
天工開物![]() 記載:“凡埏泥造瓦,掘地二尺余,擇取無沙黏土而為之。”“瓦”是傳統無機非金屬材料,主要成分為硅酸鹽。
記載:“凡埏泥造瓦,掘地二尺余,擇取無沙黏土而為之。”“瓦”是傳統無機非金屬材料,主要成分為硅酸鹽。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com