
【題目】在室溫下,下列五種溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
請根據要求填寫下列空白:
(1)溶液①呈_____性(填“酸”、“堿”或“中”),其原因是________(用離子方程式表示)。
(2)比較②③溶液中,c(NH4+)的大小關系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 離子的濃度為0.1mol/L;NH3H2O和_____離子的物質的量濃度之和為0.2mol/L。
(4)室溫下,測得溶液②的pH=7,則CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-與NH4+濃度的大小關系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
【答案】酸 NH4++H2O![]() NH3H2O+H+
NH3H2O+H+ ![]() Cl- NH4+ = =
Cl- NH4+ = =
【解析】
(1)氯化銨溶液中銨根離子水解顯酸性;
(2)酸溶液中氫離子濃度越大,溶液pH越小,結合銨根離子水解的影響因素分析;
(3)0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液中,氯離子不變,銨根離子水解,依據離子性質和物料守恒分析;
(4)醋酸根離子水解程度和銨根離子水解程度幾乎相同。
(1)氯化銨溶液中銨根離子水解顯酸性,NH4++H2O![]() NH3H2O+H+;
NH3H2O+H+;
(2)②0.1mol/L CH3COONH4中CH3COO-水解會促進NH4+的水解;
③0.1mol/L NH4HSO4 溶液中電離出氫離子顯酸性,抑制銨根離子水解;
上述分析可知酸性最強的是0.1mol/L NH4HSO4溶液,銨根離子濃度c(NH4+):②<③;
(3)在④中0.1mol/L NH3H2O和0.1mol/LNH4Cl混合液中,氯離子物質的量不變,濃度不變,濃度為0.1mol/L,銨根離子水解,一水合氨電離,一水合氨的電離作用大于銨根離子的水解作用,使溶液呈堿性,根據溶液中料守恒可知,c(NH3H2O)+c(NH4+)=0.2mol/L;
(4)測得溶液②的pH=7,醋酸根離子水解程度和銨根離子水解程度幾乎相同,則CH3COO-與NH4+濃度的大小關系是相同。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】向1L的密閉容器中加入1molX、0.3molZ和一定量的Y三種氣體。一定條件下發生反應,各物質的濃度隨時間變化如圖一所示。圖二為t2時刻后改變反應條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種不同的條件。下列說法不正確的是
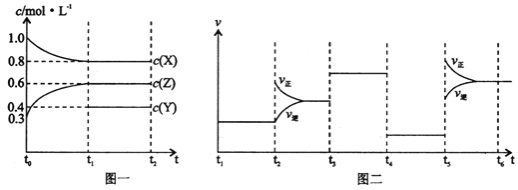
A.Y的起始物質的量為0.5mol
B.該反應的化學方程式為:2X(g)+Y(g)![]() 3Z(g)H<0
3Z(g)H<0
C.若t0=0,t1=10s,則t0~t1階段的平均反應速率為v(Z)=0.03mol/(L·s)
D.反應物X的轉化率t6點比t3點高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種釕(Ru)基配合物光敏染料敏化太陽能電池的原理及電池中發生的主要反應如圖所示。下列說法正確的是

A. 鍍鉑導電玻璃的作用是傳遞I-
B. 電池工作時,光能轉變為電能,X為電池的正極
C. 電池的電解質溶液中I-和I3-的濃度均不斷減小
D. 電解質溶液中發生反應2Ru3++3I-═2Ru2++I3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知1 g氫氣完全燃燒生成水蒸氣時放出熱量121 kJ,且氧氣中1 mol O=O鍵完全斷裂時吸收熱量496 kJ,水蒸氣中1mol H-O鍵形成時放出熱量463 kJ,則氫氣中1mol H-H鍵斷裂時吸收熱量為
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰錳電池的體積小、性能優良,是常用的一次電池。該電池反應原理如圖所示,其中電解質LiClO4,溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2。 回答下列問題:

(1)外電路的電流方向是由________極流向________極(填字母)。
(2)電池正極反應式為___________________________________。
(3)是否可用水代替電池中的混合有機溶劑?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可與KOH和KClO3在高溫下反應,生成K2MnO4,反應的化學方程式為_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物質的量之比為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關同分異構體的敘述正確的是( )
A.![]() 苯環上的一氯取代物有5種
苯環上的一氯取代物有5種
B.丁烷(C4H10)的二氯取代物最多有4種
C.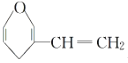 和
和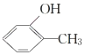 互為同分異構體
互為同分異構體
D.菲的結構簡式為![]() ,其一硝基取代物有10種
,其一硝基取代物有10種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人體血液存在![]() 、
、![]() 等緩沖對。常溫下,水溶液中各緩沖對的微粒濃度之比的對數值lgx[x表示
等緩沖對。常溫下,水溶液中各緩沖對的微粒濃度之比的對數值lgx[x表示![]() 或
或![]() ]與
]與![]() 的關系如圖所示。已知碳酸
的關系如圖所示。已知碳酸![]() 、磷酸
、磷酸![]() 。則下列說法正確的是
。則下列說法正確的是

A.曲線![]() 表示lg(
表示lg(![]() )與
)與![]() 的變化關系
的變化關系
B.![]() 的過程中,水的電離程度逐漸減小
的過程中,水的電離程度逐漸減小
C.當![]() 時
時![]()
D.當![]() 增大時,
增大時,![]() 逐漸減小
逐漸減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A是制造新型信息材料的中間體,B是制備血管緊張素抑制劑卡托普利的原料,它們有如下的轉化關系:
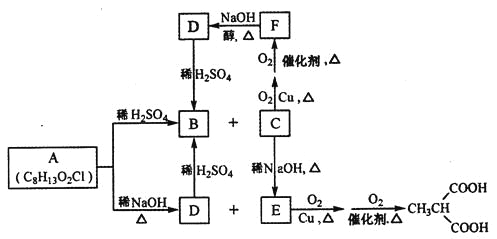
試回答下列問題:
(1)B的名稱是______________,C含有的官能團名稱是_____________。
(2)C→E的反應類型是_____________,C→F的反應類型是______________。
(3)A的結構簡式為____________。
(4)寫出與F具有相同官能團的F的所有同分異構體_____________(填結構簡式)
(5)已知![]() ,請以2一甲基丙醇和甲醇為原料,設計制備有機玻璃(聚甲基丙烯酸甲酯)的合成路線.合成路線流程圖示例如下:___________________
,請以2一甲基丙醇和甲醇為原料,設計制備有機玻璃(聚甲基丙烯酸甲酯)的合成路線.合成路線流程圖示例如下:___________________![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在Fe(NO3)3和Cu(NO3)2的混合液中逐漸加入鐵粉,溶液中Fe2+的物質的量濃度和加入鐵粉的物質的量之間關系如圖所示,則該溶液中Fe(NO3)3與Cu(NO3)2的物質的量濃度之比為
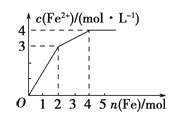
A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com