
【題目】酸性KMnO4在生產、生活、衛生醫療中常用作消毒劑,高錳酸鉀造成的污漬可用還原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化試劑,下面是對這兩種氧化劑性質的探究。
(1)取300 mL 0.2 mol/L的KI溶液與一定量的酸性KMnO4溶液恰好反應,生成等物質的量的I2和KIO3,則轉移電子的物質的量的是________mol。
(2)測定KMnO4樣品的純度可用標準Na2S2O3溶液進行滴定,取0.395 g KMnO4樣品溶解酸化后,用0.100 mol/L標準Na2S2O3溶液進行滴定,標準Na2S2O3溶液應盛裝在________(填“酸式”或“堿式”)滴定管中。實驗中,滴定至終點時消耗Na2S2O3溶液12.50 mL,則該樣品中KMnO4的質量分數是________。(有關離子方程式為:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,過一會又變為棕黃色。溶液先變為淺綠色的離子方程式是_______________,又變為棕黃色的離子方程式是__________。
【答案】0.16 堿式 80.0% 2Fe3++SO32-+ H2O === 2Fe2++SO42-+2H+ 3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
【解析】
(1)n(KI)=0.06mol,與一定量的酸性KMnO4溶液恰好反應,生成等物質的量的I2和KIO3,則n(I2)=n(KIO3)=0.02mol,結合化合價的變化計算轉移的電子的數目;
(2)Na2S2O3溶液水解顯堿性;根據方程式中 8MnO4---5S2O32-,計算消耗的高錳酸鉀的物質的量,再計算樣品中KMnO4的質量分數;
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,原因是Fe3+與SO32-發生氧化還原反應生成Fe2+和SO42-,反應后溶液呈酸性,則在酸性條件下NO3-與Fe2+反應生成Fe3+,過一會又變為棕黃色。
(1)300mL0.2mol/L的KI溶液中:n(KI)=0.2mol/L×0.3L=0.06mol,與一定量的酸性KMnO4溶液恰好反應,生成等物質的量的I2和KIO3,則n(I2)=n(KIO3)=0.02mol,失電子的物質的量為:2×0.02mol+0.02mol×[5-(-1)]=0.16mol,即轉移電子的物質的量為0.16mol,故答案為:0.16;
(2)Na2S2O3溶液水解顯堿性,標準Na2S2O3溶液應盛裝在堿式滴定管中;測定KMnO4樣品的純度可用標準Na2S2O3溶液進行滴定,取0.395gKMnO4樣品溶解酸化后,用0.100mol/L標準Na2S2O3溶液進行滴定,滴定至終點時,溶液紫紅色褪去且30秒內顏色不再變化;根據方程式中 8MnO4-----5S2O32-得n(KMnO4)=![]() ×8=0.002mol,m(KMnO4)=158g/mol×0.002mol=0.316g,質量分數=
×8=0.002mol,m(KMnO4)=158g/mol×0.002mol=0.316g,質量分數=![]() ×100%=80%,故答案為:堿式;80%;
×100%=80%,故答案為:堿式;80%;
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,原因是Fe3+與SO32-發生氧化還原反應生成Fe2+和SO42-,反應的離子方程式為2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,反應后溶液呈酸性,則在酸性條件下NO3-與Fe2+反應生成Fe3+,過一會又變為棕黃色,反應的離子方程式為:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案為:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。


科目:高中化學 來源: 題型:
【題目】300 ℃時,將2 mol A和2 mol B兩種氣體混合于2 L密閉容器中,發生如下反應:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末達到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末達到平衡,生成0.8 mol D。
(1)300 ℃時,該反應的平衡常數表達式為:K=___________________。已知K300 ℃<K350 ℃,則ΔH______0(填“>”或“<”)。
(2)在2 min末時,B的平衡濃度為________,D的平均反應速率為________。
(3)若溫度不變,縮小容器容積,則A的轉化率______(填“增大”“減小”或“不變”),原因是_____________________________________________________________。
(4)如果在相同的條件下,上述反應從逆反應方向進行,開始時加入C、D各4/3mol。若使平衡時各物質的物質的量濃度與原平衡相同,則還應該加入B______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普拉西坦是一種能改善記憶、抗健忘的中樞神經藥。下列關于普拉西坦的說法正確的是 ( )
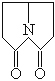
A. 一氯取代物只有5種
B. 二氯取代物只有5種
C. 可發生水解反應
D. 與2-氨基環丁二烯丙酸互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩種氣態烴組成的混合氣體完全燃燒后所得CO2和H2O的物質的量隨混合烴總物質的量的變化如圖所示,則下列對混合烴的判斷正確的是:
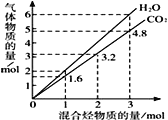
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定沒有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酸性廢水中的NH4+可在一定條件下利用硝酸鹽菌轉化為NO3-,再用圖示的電化學裝置除去NO3-下列有關說法正確的是
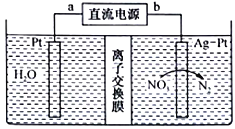
A. a端是直流電源的負極
B. 該裝置把化學能轉化為電能
C. 圖中離子交換膜應為陰離子交換膜
D. 陰級的電極反應式為2NO3-+12H++10e-=N2↑+6H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,10mL0.40mol/LH2O2溶液發生催化分解,不同時刻測得生成O2的體積(已折算為標準狀況)如下表。忽略溶液體積變化,下列敘述不正確的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min時H2O2的濃度c(H2O2)=0.314mol/L
B. 0~4 min的平均反應速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,過氧化氫的平均反應速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反應到6 min時,H2O2分解了50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應①X(g)+2Y(g)![]()
![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分別在密閉容器的兩個反應室中進行,反應室之間有無摩擦、可滑動的密封隔板。反應開始和達到平衡狀態時有關物理量的變化如圖示:
N(g)+P(g)分別在密閉容器的兩個反應室中進行,反應室之間有無摩擦、可滑動的密封隔板。反應開始和達到平衡狀態時有關物理量的變化如圖示:
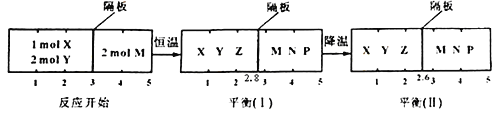
下列判斷正確的是
A. 反應①的正反應是吸熱反應
B. 達平衡(I)時體系的壓強與反應開始時體系的壓強之比為14:15
C. 達平衡(I)時,X的轉化率為![]()
D. 在平衡(I)和平衡(II)中M的體積分數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國三峽工程所提供的清潔、廉價、可再生的水電,相當于每年燃燒3000萬噸原煤的火力發電廠產生的電能,因此三峽工程有助于控制
①溫室效應 ②S02的排放 ③白色污染 ④臭氧空洞
A. ①②③④ B. ①②③ C. ①②④ D. ①②
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com