
分析 (1)從Cl2+H2O HCl+HClO 平衡移動的角度分析;
HCl+HClO 平衡移動的角度分析;
(2)碳酸鈣是過量的,碳酸鈣和二氧化碳和水反應生成了可溶于水的碳酸氫鈣,以此書寫反應的有關離子方程式;
(3)根據有關反應判斷可能的產物.
解答 解:(1)在飽和氯水中存在如下平衡:Cl2+H2O?HClO+HCl,鹽酸的酸性比碳酸強,而HClO的酸性比碳酸弱,加入過量的CaCO3與溶液中的HCl發生反應,使鹽酸的濃度減小,平衡向正反應方向移動,最終生成HClO;
故答案為:在飽和氯水中存在:Cl2+H2O?HClO+HCl,加入過量的CaCO3與溶液中的HCl發生反應,使鹽酸的濃度減小,平衡向正反應方向移動,HClO的濃度增大;
(2)因為碳酸鈣是過量的,碳酸鈣和二氧化碳和水反應生成了可溶于水的碳酸氫鈣,與石灰水混合,立即產生大量白色沉淀,反應的離子方程式為Ca2++HCO3-+OH-=CaCO3↓+H2O,加熱時碳酸氫鈣分解生成CaCO3和CO2,反應的離子方程式為Ca2++2HCO3- $\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O,
故答案為:Ca2++HCO3-+OH-=CaCO3↓+H2O;Ca2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$ CaCO3↓+CO2↑+H2O;
(3)氯氣與水反應Cl2+H2O?HCl+HClO,生成HClO,因為碳酸鈣是過量的,并且反應中有二氧化碳生成,
因此碳酸鈣和二氧化碳和水反應生成了可溶于水的碳酸氫鈣CaCO3+H2O+CO2=Ca(HCO3)2,
因此第二份與稀鹽酸混合Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,
所以②的濾液中含有的溶質除了極少量的氯氣外,還有HClO、Ca(HCO3)2、CaCl2,
故答案為:HClO、Ca(HCO3)2、CaCl2.
點評 本題考查律氯氣的性質以及氯水的性質,題目難度中等,本題注意過量碳酸鈣與氯水反應的原理,此為解答該題的關鍵,本題易錯點為(3)過量的CaCO3與飽和氯水反應生成Ca(HCO3)2.


 小學生10分鐘口算測試100分系列答案
小學生10分鐘口算測試100分系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{17}^{37}$Cl表示質子數為17、中子數為20的核素 | |
| B. | 乙二醇(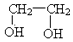 )和甘油( )和甘油(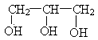 )互為同系物 )互為同系物 | |
| C. | 干冰和CO2互為同分異構體 | |
| D. | 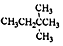 的名稱是3,3-二甲基丁烷 的名稱是3,3-二甲基丁烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| Na2SO3 | Kal=1.54×l0-2 | Ka2=1.02×10-7 |
| HCIO | Ka1=2.95×10-8 | |
| H2CO3 | Kal=4.3×10-7 | Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油的分餾和裂化均屬于化學變化 | |
| B. | 花生油、石油、羊油和牛油均屬于高級脂肪酸甘油酯 | |
| C. | 煤在空氣中經過高溫強熱制得焦炭、苯等化工原料 | |
| D. | 汽油、柴油通常作為汽車的燃料,是一種清潔的燃料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向苯酚鈉溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液與足量NaOH溶液反應:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 澄清石灰水與少量小蘇打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 可能含有一個酯基和一個碳碳雙鍵 | B. | 可能含有一個醛基和一個羰基 | ||
| C. | 可能含有一個環和一個酯基 | D. | 可能含有一個醛基和一個碳碳叁鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 某化學興趣小組進行化學實驗,按照圖1連接好線路發現燈泡不亮,按照圖2連接好線路發現燈泡亮,由此得出的結論正確的是( )
某化學興趣小組進行化學實驗,按照圖1連接好線路發現燈泡不亮,按照圖2連接好線路發現燈泡亮,由此得出的結論正確的是( )| A. | NaCl溶液是電解質 | |
| B. | 電解質在電流的作用下才發生電離 | |
| C. | NaCl溶液中的水電離出大量的離子 | |
| D. | NaCl在水溶液中存在自由移動的離子是溶液能導電的原因 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com