
分析 ①A有刺激性氣味,用沾有濃鹽酸的玻璃棒接近A時產生白色煙霧,說明A為NH3•H2O;
②將A分別加入其它五種溶液中,只有D、F中有沉淀產生;繼續加入過量A時,D中沉淀無變化,可能為Al(OH)3或Mg(OH)2,F中沉淀完全溶解,則F為AgNO3,D可能為Al2(SO4)3或MgSO4;
③將B分別加入C、D、E、F中,C、D、F中產生沉淀,E中有無色、無味氣體逸出,該氣體為CO2,說明E為酸溶液,且純E為無色油狀液體,說明E為H2SO4;
④將C分別加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,則該沉淀可能為BaSO4或AgCl,則C應為BaCl2,B可能為Na2CO3或K2CO3.其中一種沉淀在醫療上有非常重要的用途,其密度很大,且能夠阻止X射線通過,說明生成硫酸鋇沉淀,以此解答該題.
解答 解:①A有刺激性氣味,用沾有濃鹽酸的玻璃棒接近A時產生白色煙霧,說明A為NH3•H2O;
②將A分別加入其它五種溶液中,只有D、F中有沉淀產生;繼續加入過量A時,D中沉淀無變化,可能為Al(OH)3或Mg(OH)2,F中沉淀完全溶解,則F為AgNO3,D可能為Al2(SO4)3或MgSO4;
③將B分別加入C、D、E、F中,C、D、F中產生沉淀,E中有無色、無味氣體逸出,該氣體為CO2,說明E為酸溶液,且純E為無色油狀液體,說明E為H2SO4;
④將C分別加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,則該沉淀可能為BaSO4或AgCl,則C應為BaCl2,B可能為Na2CO3或K2CO3.其中一種沉淀在醫療上有非常重要的用途,其密度很大,且能夠阻止X射線通過,說明生成硫酸鋇沉淀,
(1)由以上分析可知A為NH3•H2O,C為BaCl2,故答案為:NH3•H2O;BaCl2;
(2)F為AgNO3,生成的沉淀為AgOH,與氨水發生絡合反應,方程式為AgOH+2NH3•H2O=Ag (NH3)2++OH-+2H2O,
故答案為:AgOH+2NH3•H2O=Ag (NH3)2++OH-+2H2O;
(3)B可能為Na2CO3或K2CO3,含有的陰離子為,確定陽離子,可用焰色反應檢驗,方法是用潔凈的鉑絲蘸取少量B的溶液,在酒精燈火焰中灼燒,若焰色呈黃色則B為Na2CO3溶液;若透過藍色鈷玻璃觀察焰色呈紫色,則B為K2CO3溶液,
故答案為:CO32-;用潔凈的鉑絲蘸取少量B的溶液,在酒精燈火焰中灼燒,若焰色呈黃色則B為Na2CO3溶液,若透過藍色鈷玻璃觀察焰色呈紫色,則B為K2CO3溶液;
(4)D可能為Al2(SO4)3或MgSO4,陰離子為SO42-,檢驗陽離子,可取少量D的溶液,向其中滴加NaOH溶液有沉淀生成,繼續滴加過量的NaOH溶液,若沉淀溶解,則D為Al2(SO4)3溶液,若沉淀不溶解,則D為MgSO4溶液,
故答案為:SO42-;取少量D的溶液,向其中滴加NaOH溶液有沉淀生成,繼續滴加過量的NaOH溶液,若沉淀溶解,則D為Al2(SO4)3溶液,若沉淀不溶解,則D為MgSO4溶液.
點評 本題考查無機物的推斷,為高考常見題型,題目難度中等,涉及了物質檢驗、離子方程式書寫等知識,注意掌握常見物質的檢驗方法,能夠根據反應現象判斷未知物成分,試題培養了學生的分析、理解能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
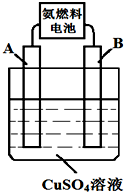 能源的開發、利用與人類社會的可持續發展息息相關,怎樣充分利用好能源是擺在人類面前的重大課題.
能源的開發、利用與人類社會的可持續發展息息相關,怎樣充分利用好能源是擺在人類面前的重大課題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol鈉與氧氣反應生成Na2O或Na2O2時,失電子數目均為NA | |
| B. | 將含有0.1molFeCl3的飽和溶液滴入沸水中,產生膠粒的數目為0.1NA | |
| C. | 1molC7H16中含有共價鍵的數目為23NA | |
| D. | 常溫下,1L 0.1 mol•L-1的Na2CO3溶液中含有的離子總數為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 參加反應的硝酸的物質的量為0.4mol | |
| B. | 加入合金的質量可能為9.6g | |
| C. | 沉淀完全時消耗NaOH溶液體積為150mL | |
| D. | 溶解合金時產生NO氣體體積0.224L(以標準狀況) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 試劑組合/NH3體積(mL) | 6.0gCa(OH)2(s,過量) | 6.0NaOH(s,過量) | 6.0g CaO(s,過量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有Ag+和SO42- | D. | 可能含有Ag+或SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生成SO3為2 mol | |
| B. | 反應放出197 kJ 的熱量 | |
| C. | SO2和SO3物質的量之和一定為2mol | |
| D. | SO2的物質的量和SO3物質的量一定相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com