
分析 (1)根據蓋斯定律結合已知熱化學方程式來解答;
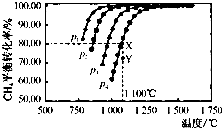
(2)①由圖可知,壓強一定時,溫度越高甲烷的轉化率越大,升高溫度平衡向正反應進行,據此判斷;
②由圖可知,溫度一定時,甲烷的轉化率α(P1)>α(P2)>α(P3)>α(P4),據此結合方程式判斷壓強對平衡移動的影響進行解答;
③由圖可知,壓強為P4、1100℃的條件下,到達平衡X點時甲烷的轉化率為80%,據此計算甲烷的濃度變化量,利用三段式計算平衡時各組分的平衡濃度,代入平衡常數表達式計算該溫度下的平衡常數;
④由于是將Y點平衡體系轉化為X點,而通過圖象可知,Y平衡體系和X平衡體系所處的溫度相同而壓強不同,且Y點的壓強更大,故由Y點變為X點是通過減小體系壓強來實現,據此分析;
(3)①CO2和CH4直接轉化成乙酸,由反應物、生成物結合質量守恒定律書寫反應方程式;
②Cu2Al2O4溶解在稀硝酸中,發生氧化還原反應生成硝酸銅、硝酸鋁、NO和水;
(4)①反應中Fe元素化合價升高,C元素化合價降低,計算生成C的物質的量,結合C元素化合價變價計算轉移電子物質的量;
②根據原電池原理,CO2在正極發生還原反應轉化為甲烷,注意電解質溶液為堿性.
解答 解:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=akJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=bkJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=ckJ•mol-1 ③
根據蓋斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=+(a+2b?2c)kJ•mol-1.
故答案為:+(a+2b?2c)KJ/mol;
(2)①由圖可知,壓強一定時,溫度越高甲烷的轉化率越大,升高溫度平衡向正反應進行,故正反應為吸熱反應,即△H>0,故答案為:>;
②由圖可知,溫度一定時,甲烷的轉化率α(P1)>α(P2)>α(P3)>α(P4),該反應正反應是氣體體積增大的反應,增大壓強平衡向逆反應進行,甲烷的轉化率降低,故壓強P4>P3>P2>P1,故答案為:P4>P3>P2>P1;
③由圖可知,壓強為P4、1100℃的條件下,達到平衡X點時甲烷的轉化率為80%,甲烷的濃度變化量為0.1mol/L×80%=0.08mol/L,則:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
開始(mol/L):0.1 0.1 0 0
變化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故該溫度下平衡常數k=$\frac{0.1{6}^{2}×0.1{6}^{2}}{0.02×0.02}$=1.64,故答案為:1.64;
④由于是將Y點平衡體系轉化為X點,而通過圖象可知,Y平衡體系和X平衡體系所處的溫度相同而壓強不同,且Y點的壓強更大,故由Y點變為X點是通過減小體系壓強來實現.減小壓強后,反應物和生成物的濃度突然變小,故v(正)和v(逆)均立即變小,但由于平衡右移,故反應物的濃度繼續減小,而生成物的濃度后來逐漸變大,則v(正)繼續變小,v(逆)后來增大,即由Y點變為X點,v(正)一直變小,而v(逆)先變小后增大,故選D;
(3)①CO2和CH4直接轉化成乙酸,由反應物、生成物及質量守恒定律可知反應方程式為CO2+CH4$\frac{\underline{\;Cu_{2}Al_{2}O_{4}\;}}{\;}$CH3COOH,故答案為:CO2+CH4$\frac{\underline{\;Cu_{2}Al_{2}O_{4}\;}}{\;}$CH3COOH;
②Cu2Al2O4溶解在稀硝酸中,發生氧化還原反應生成硝酸銅、硝酸鋁、NO和水,化學反應為3Cu2Al2O4+32HNO3=6Cu(NO3)2+6Al(NO3)3+2NO↑+16H2O,
故答案為:3Cu2Al2O4+32HNO3=6Cu(NO3)2+6Al(NO3)3+2NO↑+16H2O;
(4)①由方程式可知,每生成1mol Fe3O4時生成0.5molC,C元素化合價由+4價降低為0價,故轉移電子為0.5mol×4=2mol,故答案為:2;
②CO2在正極發生還原反應轉化為甲烷,電極反應為:CO2+8e-+6H2O=CH4+8OH-,陽極上是氫氧根離子失電子的氧化反應,產生氧氣,總的電解原理方程式為:CO2+2H2O$\frac{\underline{\;通電\;}}{\;}$CH4+2O2,故答案為:正;CO2+2H2O$\frac{\underline{\;通電\;}}{\;}$CH4+2O2
點評 本題主要考查蓋斯定律、影響化學反應速率和平衡的因素以及原電池原理的運用等知識,綜合性較強,是高考的常見題型.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在101 k Pa時,1 mol C與適量O2反應生成1mol CO時,放出110.5 kJ熱 量,則C的燃燒熱為110.5 kJ/mol | |
| B. | 在10l k Pa時l mol H2完全燃燒生成液態水放出285.8 kJ熱量,H2燃燒熱為-285.8kJ/mol | |
| C. | 鑒定HCl和NaOH反應的中和熱時,每次實驗均應測量3個溫度即鹽酸起始溫度、NaOH起始溫度和反應后終止溫度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若將含0.5molH2SO4的濃硫酸與含1mol NaOH的溶液混合,放出的熱量等于57.3KJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:
甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水時,陰極的電極反應式為 2Cl--2e-═Cl2↑ | |
| B. | 放電時,鉛蓄電池中硫酸濃度不斷減小 | |
| C. | 氫氧燃料電池中,當電路上有1mol 電子通過時,則正極上消耗氧氣為5.6L | |
| D. | 以鋅片、銅片、稀硫酸組成原電池,當溶液中通過0.2mol電子時,負極減輕6.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①=④>③=② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ④>①=③>② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 NH4NO3主要用作肥料、軍用炸藥、冷凍劑、制造笑氣等.
NH4NO3主要用作肥料、軍用炸藥、冷凍劑、制造笑氣等.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com