
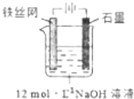
 高鐵酸鉀(K2FeO4)是一種高效多功能水處理劑,具有極強的氧化性.
高鐵酸鉀(K2FeO4)是一種高效多功能水處理劑,具有極強的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鹽和KNO2等產物 |
| 濕法 | 強堿性介質中,Fe(NO3)3與NaClO反應生成紫紅色高鐵酸鹽溶液 |
| 電解法 | 制備中間產物Na2FeO4,再與KOH溶液反應 |
分析 (1)高鐵酸鉀(K2FeO4)具有極強的氧化性,是一種優良的水處理劑,起到殺菌消毒作用,形成膠體具有吸附懸浮雜質的作用;依高鐵酸根離子水解平衡移動的影響因素解答;
(2)①Fe2O3、KNO3、KOH混合加熱發生氧化還原反應,Fe元素化合價升高,化合價由+3價升高到+6價,被氧化,N元素化合價由+5價降低到+3價,依據氧化還原反應得失電子守恒規律計算;
②由信息可知,堿性介質中K2FeO4與Fe3+發生氧化還原反應生成K3FeO4,根據元素守恒還應生成H2O,反應中FeO42-→FeO43-,鐵元素化合價由+6價降低為+5價,總共降低1價,Fe3+→FeO43-,鐵元素化合價由+3價升高為+5價,總共升高2價,化合價升降最小公倍數為2,所以FeO42-系數為2,Fe3+系數為1,根據鐵元素守恒確定FeO43-系數,根據電荷守恒確定OH-系數,根據氫元素守恒確定H2O系數,檢查氧元素守恒,據此寫出氧化還原反應方程式;
③電解時陽極Fe失電子發生氧化反應,被氧化生成高鐵酸根離子;
(3)放電時,為原電池,依據3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,鋅化合價升高,發生氧化反應,做負極,高鐵酸根離子在正極得到電子,發生還原反應生成氫氧化鐵;
(4)依據溶度積規則,當Qc=Ksp達到沉淀溶解平衡,要產生沉淀則Qc>Ksp,據此解答.
解答 解:(1)K2FeO4具有強氧化性,能夠消毒殺菌;同時FeO42- 被還原成Fe3+,Fe3+水解形成Fe(OH)3膠體,能夠吸附水中懸浮雜質;4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,增大溶液中的氫氧根離子濃度,能夠使平衡逆向移動,抑制高鐵酸根離子的水解,所以同濃度的高鐵酸鉀在pH為11.50的水溶液中最穩定;
故答案為:K2FeO4具有強氧化性,能夠消毒殺菌;同時FeO42- 被還原成Fe3+,Fe3+水解形成Fe(OH)3膠體,能夠吸附水中懸浮雜;11.50;
(2)①Fe元素化合價升高,化合價由+3價升高到+6價,被氧化,Fe2O3做還原劑;N元素化合價由+5價降低到+3價,KNO3做氧化劑,設氧化劑物質的量為xmol,還原劑物質的量為ymol,要使氧化劑得到電子總數等于還原劑失去電子總數,x×(5-3)=y×2×(6-3),解得x:y=3:1;
故答案為:3:1;
②由信息可知,堿性介質中K2FeO4與Fe3+發生氧化還原反應生成K3FeO4,根據元素守恒還應生成H2O,反應中FeO42-→FeO43-,鐵元素化合價由+6價降低為+5價,總共降低1價,Fe3+→FeO43-,鐵元素化合價由+3價升高為+5價,總共升高2價,化合價升降最小公倍數為2,所以FeO42-系數為2,Fe3+系數為1,根據鐵元素守恒確定FeO43-系數為3,根據電荷守恒確定OH-系數8,根據氫元素守恒確定H2O系數為4,反應離子方程式為2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
故答案為:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③電解時陽極Fe失電子發生氧化反應,電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O;
故答案為:Fe+8OH--6e-═FeO42-+4H2O;
(3)放電時,為原電池,依據3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,鋅化合價升高,發生氧化反應,做負極,高鐵酸根離子在正極得到電子,發生還原反應生成氫氧化鐵,電極反應式為:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
故答案為:Zn;FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
(4)設加入Ca(OH)2的物質的量為xmol,則溶液中鈣離子濃度為x×10-3mol/L,含有2.0×l0-4 mol•L-lK2FeO4的廢水中的c(FeO42-)=2.0×l0-4 mol•L-l,
Qc=x×10-3mol/L×2.0×l0-4 mol•L-l=Ksp=4.54×l0-9;
解得:x=2.27×10-2;
故答案為:2.27×10-2.
點評 本題為綜合題,考查了氧化還原反應方程式的書寫及配平、電極反應式的書寫、溶度積規則的應用,題目難度較大,明確物質的性質及題給信息、熟悉化合物中各元素化合價、沉淀溶解平衡規律是解本題關鍵,氧化還原方程式的書寫是難點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na+、Cl-、Al3+、Ag+ | B. | $NH_4^+$、Mg2+、$NO_3^-$、$SO_4^{2-}$ | ||
| C. | K+、Ca2+、$NO_3^-$、$CO_3^{2-}$ | D. | $HCO_3^-$、Na+、K+、$SO_4^{2-}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
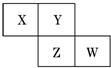 X、Y、Z、W均為短周期元素,它們在元素周期表中的相對位置如圖所示.若Z原子的最外層電子數是第一層電子數的3倍,下列說法中正確的是( )
X、Y、Z、W均為短周期元素,它們在元素周期表中的相對位置如圖所示.若Z原子的最外層電子數是第一層電子數的3倍,下列說法中正確的是( )| A. | X的最常見氣態氫化物的水溶液顯酸性 | |
| B. | 最高價氧化物對應水化物的酸性W比Z強 | |
| C. | Z的單質與氫氣反應比Y單質與氫氣反應劇烈 | |
| D. | X的原子半徑小于Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將Fe(N03)2樣品溶于稀H2SO4后,滴加KSCN溶液,溶液變紅,則Fe(N03)2晶體已氧化變質 | |
| B. | 常溫下,pH都為11的氫氧化鈉溶液和氨水均加水稀釋100倍,pH都變為9 | |
| C. | 25℃時,Ksp( BaC03)>Ksp( BaCrO4),則沉淀水體中的Ba2+選擇Na2CrO4比Na2CO3好 | |
| D. | 將CH3CH2Br與NaOH溶液共熱,冷卻后取出上層溶液,加入AgNO3溶液,產生沉淀,則CH3CH2Br在NaOH溶液中發生了水解 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
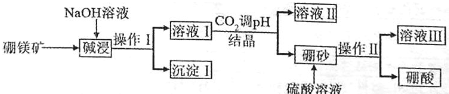
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
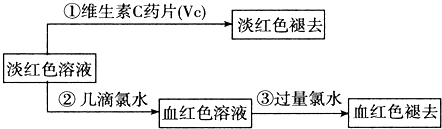
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com