
| A. | 常溫下,能穩定存在的R的氧化物都是酸性氧化物 | |
| B. | R的氣態氫化物的水溶液具有強酸性 | |
| C. | R是金屬元素 | |
| D. | R的氣態氧化物不能在氧氣中燃燒 |
分析 第三周期元素R,有3個電子層,次外層和最內層的電子數之差為8-2=6,它的原子核外最外層實現8電子穩定結構所需的電子數小于6,且等于最內層電子數的整數倍,則R元素原子核外最外層實現8電子穩定結構所需的電子數為2或4,若為2,則R為硫元素,符合題意;若為4,則R為硅元素,符合題意.結合元素化合物性質判斷.
解答 解:第三周期元素R,有3個電子層,次外層和最內層的電子數之差為8-2=6,它的原子核外最外層實現8電子穩定結構所需的電子數小于6,且等于最內層電子數的整數倍,則R元素原子核外最外層實現8電子穩定結構所需的電子數為2或4,若為2,則R為硫元素,符合題意;若為4,則R為硅元素,符合題意.
A、S、Si的氧化物為SO2、SO3、SiO2,都是酸性氧化物,故A正確;
B、Si元素的氫化物的化學式為SiH4,難溶于水沒有強酸性,故B錯誤;
C、R為S或Si元素,屬于非金屬元素,故C錯誤;
D、若R為Si元素,則Si沒有氣態氧化物,故D錯誤.
故選:A.
點評 本題以元素推斷為載體,考查原子結構位置與性質關系、元素化合物知識,題目難度不大,推斷元素是解題的關鍵.


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 食鹽和醋都是常用的食品添加劑 | |
| B. | 鈣、鐵、碘都是人體內必需的微量元素 | |
| C. | ClO2、O3等均可用于飲用水消毒 | |
| D. | 靜脈滴注NaHCO3溶液可治療水楊酸中毒反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
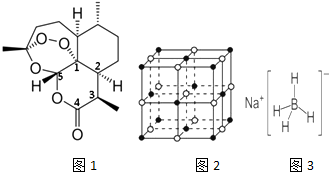
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
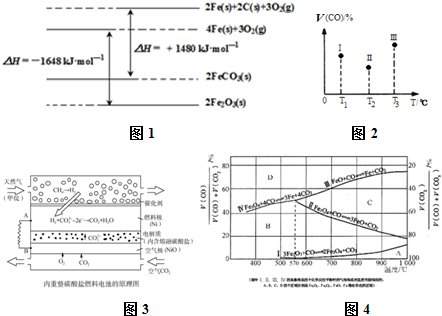
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮及其化合物與人類生產、生活息息相關.回答下列問題:
氮及其化合物與人類生產、生活息息相關.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
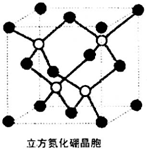 H2O和CS2分子中的原子都達到穩定結構.
H2O和CS2分子中的原子都達到穩定結構.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
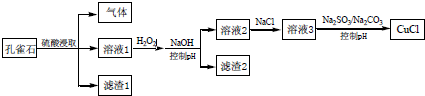
| A. | H2O2 將溶液1 中Fe2+氧化為Fe3+,再通過控制pH 轉化為Fe(OH)3除去 | |
| B. | CO32-作用是控制溶液pH,促使CuCl 沉淀的生成 | |
| C. | SO32-將溶液3 中的Cu2+還原,反應得到CuCl | |
| D. | 若改變試劑加入順序,將溶液3緩慢加入到含大量$\frac{S{O}_{3}^{2-}}{C{O}_{3}^{2-}}$的溶液中,同樣可制取CuCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | ||
| Y | Z |
| A. | Y的最高價氧化物對應水化物的酸性比Z的弱 | |
| B. | Y的氣態氫化物的穩定性較Z的強 | |
| C. | 非金屬性:X>Y>Z | |
| D. | 原子半徑:Z>Y>X |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com