
| Q-393.51 |
| 395.41-Q |
| Q-393.51 |
| 395.41-Q |
 ,
,| Q-393.51 |
| 395.41-Q |
| Q-393.51 |
| 395.41-Q |


 文敬圖書課時先鋒系列答案
文敬圖書課時先鋒系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
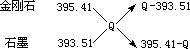
1840年蓋斯根據一系列實驗事實得出規律,他指出:“若是一個反應可以分步進行,則各步反應的反應熱總和與這個反應一次發生時的反應熱相同。”這是在各反應于相同條件下完成時的有關反應熱的重要規律,稱為蓋斯定律。已知金剛石和石墨分別在氧氣中完全燃燒的熱化學方程式為:C(金剛石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,則金剛石轉化石墨時的熱化學方程式為:___________。由此看來更穩定的碳的同素異形體為:____________。若取金剛石和石墨混合晶體共1mol 在O2中完全燃燒,產生熱量為QkJ,則金剛石和石墨的物質的量之比為_____________(用含Q的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
1840年蓋斯根據一系列實驗事實得出規律,他指出:“若是一個反應可以分步進行,則各步反應的吸收或放出的熱量總和與這個反應一次發生時吸收或放出的熱量相同。”這是18世紀發現的一條重要規律,稱為蓋斯定律。已知1mol 金剛石和石墨分別在氧氣中完全燃燒時放出的熱量為:金剛石,395.41kJ;石墨,393.51kJ。則金剛石轉化石墨時,放熱還是吸熱?_______,其數值是 _,由此看來更穩定的是_______。若取金剛石和石墨混合晶體共1mol 在O2中完全燃燒,產生熱量為QkJ,則金剛石和石墨的物質的量之比為_____________(用含Q的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
將化學知識的系統化,有助于對化學問題的進一步認識。請你參與下列關于化學反應的討論。
問題1:化學變化過程中的平衡狀態可以通過改變反應條件而發生變化。對電離平衡、水解平衡、化學平衡等各種平衡移動的方向與外界條件變化的關系請你運用一句話進行總結:______________。
問題2:不同化學反應進行的快慢和程度千差萬別。在復雜的反應中,要考慮反應的先后順序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物質的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至過量,并不斷攪拌,依次發生了數個離子反應;其中
(1)第二個離子反應的離子方程式是
(2)最后一個離子反應的離子方程式是
問題3:化學反應的復雜性決定了反應方程式計量數的復雜性。對下列化學反應:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果該反應方程式中I2和KIO3的系數不是5,可能的配平系數還有許多組。請你再寫出一個配平的該反應的化學方程式: 。
問題4:1840年蓋斯根據一系列實驗事實得出規律:“若是一個反應可以分步進行,則各步反應的反應熱總和與這個反應一次發生時的反應熱相同。”這是在各反應于相同條件下完成時的有關反應熱的重要規律。已知金剛石和石墨分別在氧氣中完全燃燒的熱化學方程式為:C(金剛石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,則金剛石轉化石墨時的熱化學方程式為: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com