
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②④ |
分析 弱電解質是指:在水溶液里部分電離的電解質,電解質分子、電離出的離子共存,據此即可解答.
解答 解:①常溫下NaNO2溶液,根據鹽類水解的規律,無弱不水解,有弱才水解,越弱越水解,誰強顯誰性,如果NaNO2是強酸強堿鹽,PH=7,而題干中PH>7,說明NaNO2為強堿弱酸鹽,故①正確;
②用HNO2溶液做導電性實驗燈泡很暗,溶液的導電性與離子的濃度有關,弱電解質的濃度大時導電實驗中燈泡也很亮,沒有對比實驗,無法說明HNO2是弱電解質,故②錯誤;
③HNO2與NaCl不能反應,無論亞硝酸是強酸還是弱酸,它們間都不反應,故③錯誤;
④0.1mol/L HNO2溶液的PH=2.1.如果亞硝酸是強酸,0.1mol/L HNO2溶液的PH應該等于1,而此時PH=2.1,說明電離出的氫離子濃度小,說明HNO2為弱電解質,故④正確;
故選C.
點評 本題考查酸的通性及弱電解質的判斷,明確弱電解質的判斷方法是利用電離的不完全性或存在電離平衡來分析是解答本題的關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 分子數之比為1:1 | B. | 原子數之比為1:1 | C. | 原子數之比為3:2 | D. | 物質的量之比2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:3 | C. | 3:1 | D. | 1:6 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
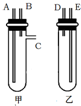 某興趣小組要進行有關氫氣的定量測定實驗,為保證氫氣不損失,設計用甲、乙兩裝置及橡膠管完成鋅粒和稀硫酸制取氫氣的操作.步驟如下:
某興趣小組要進行有關氫氣的定量測定實驗,為保證氫氣不損失,設計用甲、乙兩裝置及橡膠管完成鋅粒和稀硫酸制取氫氣的操作.步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(D)=1mol/(L•s) | B. | v(B)=1mol/(L•min) | C. | v(A)=0.5mol/(L•s) | D. | v(C)=0.8mol/(L•s) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol NH3 分子 | B. | NH3和NH4+ 總共1 mol | ||
| C. | NH3•H2O 1 mol | D. | NH3•H2O、NH3、NH4+ 總共1 mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com