
 .
. ,A2C的結構式:H-O-H.
,A2C的結構式:H-O-H. .
.分析 A、B、C、D、E為原子序數依次增大的五種短周期元素,A單質試自然界中密度最小的氣體,則A為H元素;B、C和E在周期表中相鄰,且C、E同主族,所以B、C、E在周期表中的位置關系為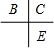 ,A和D最外層電子數相同,則二者處于同族,原子序數D大于C小于E,則D為第三周期,則D為Na;B、C的最外層電子數之和等于D的原子核外電子數,則B、C最外層電子數分別為5、6,故B為N元素,C為O元素,E為S元素,A和C可形成化合物H2O、H2O2,據此答題.
,A和D最外層電子數相同,則二者處于同族,原子序數D大于C小于E,則D為第三周期,則D為Na;B、C的最外層電子數之和等于D的原子核外電子數,則B、C最外層電子數分別為5、6,故B為N元素,C為O元素,E為S元素,A和C可形成化合物H2O、H2O2,據此答題.
解答 解:A、B、C、D、E為原子序數依次增大的五種短周期元素,A單質試自然界中密度最小的氣體,則A為H元素;B、C和E在周期表中相鄰,且C、E同主族,所以B、C、E在周期表中的位置關系為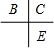 ,A和D最外層電子數相同,則二者處于同族,原子序數D大于C小于E,則D為第三周期,則D為Na;B、C的最外層電子數之和等于D的原子核外電子數,則B、C最外層電子數分別為5、6,故B為N元素,C為O元素,E為S元素,A和C可形成化合物H2O、H2O2.
,A和D最外層電子數相同,則二者處于同族,原子序數D大于C小于E,則D為第三周期,則D為Na;B、C的最外層電子數之和等于D的原子核外電子數,則B、C最外層電子數分別為5、6,故B為N元素,C為O元素,E為S元素,A和C可形成化合物H2O、H2O2.
(1)由上述分析可知,A元素的名稱是:氫,D為Na,在周期表中的位置:第三周期IA族,E的離子結構示意圖為 ,
,
故答案為:氫;第三周期IA族; ;
;
(2)N2分子的電子式: ,H2O的結構式:H-O-H,故答案為:
,H2O的結構式:H-O-H,故答案為: ;H-O-H;
;H-O-H;
(3)用電子式表示Na2S化合物的形成過程為: ,
,
故答案為: ;
;
(4)A元素最簡單的有機化合物為CH4,與赤熱的氧化銅反應生成一種單質、液態氧化物和一可以使澄清石灰水變渾濁的氣體,反應生成Cu、二氧化碳與水,反應化學方程式為:CH4+4CuO$\frac{\underline{\;高溫\;}}{\;}$4Cu+CO2+2H2O,
故答案為:CH4+4CuO$\frac{\underline{\;高溫\;}}{\;}$4Cu+CO2+2H2O;
(5)在100mL 18mol/L的濃H2SO4溶液中加入過量的銅片,加熱使之充分反應,銅片部分溶解,隨反應進行濃硫酸變為稀硫酸,稀硫酸不與Cu反應,硫酸的物質的量為0.1mol/L×18mol/L=1.8mol,發生反應:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,假設濃硫酸完全反應,生成二氧化硫為0.9mol,故實際生成二氧化硫的體積小于0.9mol×22.4L/mol=20.16L,
故選:ab.
點評 本題考查位置結構性質關系及其應用,推斷元素是解題關鍵,側重考查學生分析推理能力、知識遷移應用能力,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 224 mL | B. | 168 mL | C. | 112 mL | D. | 448 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅和濃硝酸為原料生產硝酸銅 | B. | 甲烷與氯氣制備一氯甲烷 | ||
| C. | 乙烯與HCl制取氯乙烷 | D. | 由反應2SO2+02?2SO3制SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100℃時,將pH=2的鹽酸與pH=12的NaOH溶液等體積混合,溶液顯中性 | |
| B. | 室溫下,向pH=3的醋酸溶液加水稀釋后,溶液中所有離子濃度均減小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固體,c(Ba2+)增大 | |
| D. | 向CH3COONa溶液中加入適量CH3COOH,可使c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(H+)×c(OH-)=1×10-14 | B. | 該溶液中由水電離出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
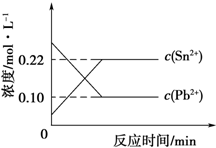 25℃時,在含有Pb2+、Sn2+的某溶液中,加入過量金屬錫(Sn),發生反應:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),體系中c(Pb2+)和c(Sn2+)變化關系如圖所示.下列判斷不正確的是( )
25℃時,在含有Pb2+、Sn2+的某溶液中,加入過量金屬錫(Sn),發生反應:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),體系中c(Pb2+)和c(Sn2+)變化關系如圖所示.下列判斷不正確的是( )| A. | 25℃時,該反應的平衡常數K=2.2 | |
| B. | 往平衡體系中加入少量 Sn(NO3)2固體后,c(Pb2+)變大 | |
| C. | 往平衡體系中加入少量金屬鉛后,c(Pb2+)增大 | |
| D. | 升高溫度,平衡體系中c(Pb2+)增大,說明該反應△H<0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com