
| 實 實驗步驟 | 預期現象與結論 |
| 步步驟1:取2mLFeSO4溶液和2mLKI溶液混合于試管中,再滴加再滴加幾滴氯水. | 溶 溶液變成黃色,推測有Fe3+或I2生成. |
| 步驟2:向試管中繼續滴加幾滴20%KSCN溶液或向試管中繼續滴加幾滴淀粉溶液 | 溶液不變紅,說明I-的還原性強于Fe2+或溶液變藍,說明I-的還原性強于Fe2+ |
分析 ①Fe2+還原性強于I-或Fe2+還原性弱于I-;
②向KI溶液中滴加氯水,溶液由無色變成黃色,向FeSO4溶液中滴加氯水,溶液由淺綠色也變成黃色;步驟2可以用淀粉溶液檢驗碘單質的存在,也可以用KSCN溶液檢驗鐵離子的存在.
解答 解:①假設1:Fe2+還原性強于I-;假設2:I-還原性強于Fe2+;
故答案為:I-還原性強于Fe2+;
②步驟2:可以用淀粉溶液檢驗碘單質的存在,溶液變藍,證明I-的還原性強于Fe2+,也可以用20%KSCN溶液檢驗鐵離子的存在,向試管中繼續滴加幾滴KSCN溶液,若溶液不變紅,也說明I-的還原性強于Fe2+,
故答案為:向試管中繼續滴加幾滴20%KSCN溶液或向試管中繼續滴加幾滴淀粉溶液;溶液不變紅,說明I-的還原性強于Fe2+或溶液變藍,說明I-的還原性強于Fe2+.
點評 本題考查性質實驗方案的設計及離子反應,把握現象與發生的氧化還原反應為解答的關鍵,側重分析能力與實驗能力的考查,綜合性較強,題目難度不大.


科目:高中化學 來源: 題型:多選題
| A. | 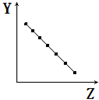 表示第三周期元素的原子半徑(稀有氣體除外) | |
| B. | 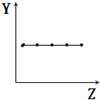 表示ⅡA族元素的最外層電子數 | |
| C. | 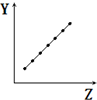 表示第二周期元素的電負性(稀有氣體除外) | |
| D. | 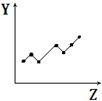 表示第三周期元素的第一電離能(稀有氣體除外) | |
| E. | 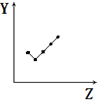 表示第ⅦA族元素氫化物的沸點. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 測得這種液體的pH值等于7 | |
| B. | 在1.01×105Pa的壓強下測得其沸點為373K | |
| C. | 電解這種液體,在陰極得到的氣體體積為陽極氣體體積的兩倍 | |
| D. | 測得該液體不導電 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(5) | D. | (1)和(4) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6 g鐵與足量氯氣完全反應轉移的電子數為0.2NA | |
| B. | 100 mL 2.0 mol•L-1的鹽酸與醋酸溶液中氫離子均為0.2NA | |
| C. | 標準狀況下,22.4 L CO2與22.4 L H2O所含原子數均為3 NA | |
| D. | 體積分別為1.0L pH=2的鹽酸與硫酸溶液中氫離子數均為0.01NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 電解后溶液中c(H+)=4mol/L | ||
| C. | 上述電解過程中共轉移8mol電子 | D. | 電解后得到的Cu的物質的量為2mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com