
分析 (1)使水在低于沸點的情況下沸騰,將蒸氣冷凝而得到淡水,為蒸餾操作;
(2)用情性電術電解200 mL含足量NaC1溶液,若陰陽兩極共得到44.8mL氣體(標準狀況),分別為氯氣、氫氣,可計算生成NaOH的物質的量,進而計算pH,氯氣和氫氧化鈉反應生成氯化鈉和次氯酸鈉;
(3)吹出法是常用的一種海水提溴技術,一般步驟是濃縮、氧化、富集、提取等操作,氯氣氧化溴化鈉生成溴,溴可與亞硫酸鈉發生氧化還原反應;
(4)氫氧化鈣成本較低;
(5)在235℃時MgC12•6H2O分解生成Mg(OH)C1、氯化氫和水蒸氣,反應的方程式為MgC12•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)C1+HCl+5H2O,結合方程式計算.
解答 解:(1)使水在低于沸點的情況下沸騰,將蒸氣冷凝而得到淡水,為蒸餾操作,故答案為:蒸餾;
(2)電解飽和食鹽水在陰極得到氫氣,陽極得到氯氣,若陰陽兩極共得到44.8mL氣體(標準狀況),則氯氣的物質的量為:$\frac{0.112L}{22.4L/mol}$=0.005mol,由2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$Cl2↑+H2↑+2NaOH 可知,Cl2↑~H2↑~2NaOH,則n(NaOH)=2n(Cl2)=2×0.005mol=0.01mol,c(NaOH)=$\frac{0.01mol}{0.1L}$=0.1mol/L,所以pH=13,氯氣和氫氧化鈉反應生成氯化鈉和次氯酸鈉,有效成分為NaClO,故答案為:13;NaClO;
(3)吹出法是常用的一種海水提溴技術,一般步驟是濃縮、氧化、富集、提取等操作,氯氣氧化溴化鈉生成溴,反應的離子方程式為Cl2+2Br-=Br2+2Cl-,溴可與亞硫酸鈉發生氧化還原反應,離子方程式為Br2+2H2O+SO2═4H++2Br-+SO42-,
故答案為:氧化;Cl2+2Br-=Br2+2Cl-;Br2+2H2O+SO2═4H++2Br-+SO42-;
(4)石灰乳制備簡單,成本較低,原料豐富,不能用氫氧化鈉代替,故答案為:石灰乳原料豐富,成本低;
(5)在235℃時MgC12•6H2O分解生成Mg(OH)C1、氯化氫和水蒸氣,反應的方程式為MgC12•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)C1+HCl+5H2O,由方程式可知生成1molHCl,則生成5mol水,則得到的鹽酸質量分數$\frac{1mol×36.5g.mol}{1mol×36.5g/mol+5mol×18g/mol}×100%$=28.9%,
故答案為:28.9.
點評 本題考查較綜合,涉及離子反應、粗鹽提純等,為高考常見題型,側重于學生的分析、計算能力的考查,把握發生的化學反應為解答的關鍵,注意離子反應與氧化還原反應的分析,題目難度不大.


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案科目:高中化學 來源: 題型:解答題
| 反應 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
| 1 | 2 | 2 | 1.33 |
| 2 | 3 | 2 | 1.57 |
| 3 | 4 | 2 | x |
| 4 | 5 | 2 | 1.76 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微粒半徑:O2-<F-<Na+<Li+ | B. | 第一電離能:He<Ne<Ar | ||
| C. | 分子中的鍵角:CH4>H2O>CO2 | D. | 共價鍵的鍵能:C-C<C=C<C≡C |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
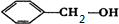 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可與鈉反應 | |
| B. | 其同類同分異構體共4種 | |
| C. | 其同類同分異構體共6種(包括其本身) | |
| D. | 完全燃燒時耗氧的質量比本身的質量小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | K+、Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
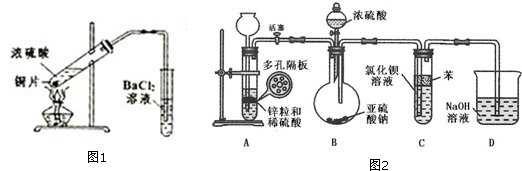
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
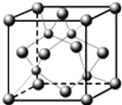 A、B、C、D都是元素周期表中的短周期元素,它們的核電荷數依次增大.第2周期元素A原子的核外成對電子數是未成對電子數的2倍,B原子的最外層p軌道的電子為半滿結構,C是地殼中含量最多的元素,D原子的S電子與P電子數相等,E是第四周期元素,其原子核外最外層電子數與氫原子相同,其余各層電子均充滿.請用對應的元素符號或化學式回答下列問題:
A、B、C、D都是元素周期表中的短周期元素,它們的核電荷數依次增大.第2周期元素A原子的核外成對電子數是未成對電子數的2倍,B原子的最外層p軌道的電子為半滿結構,C是地殼中含量最多的元素,D原子的S電子與P電子數相等,E是第四周期元素,其原子核外最外層電子數與氫原子相同,其余各層電子均充滿.請用對應的元素符號或化學式回答下列問題: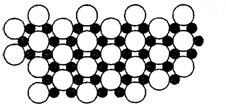
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com