

分析 根據該反應過程為:①CeO2、SiO2、Fe2O3等中加入稀鹽酸,Fe2O3轉化FeCl3存在于濾液中,濾渣為CeO2和SiO2;②加入稀硫酸和H2O2,CeO2轉化為Ce3+,濾渣為SiO2;③加入堿后Ce3+轉化為沉淀,④通入氧氣講Ce從+3氧化為+4,得到產品;
(1)CeO2、SiO2、Fe2O3等中加入稀鹽酸,根據Fe2O3轉化FeCl3書寫方程式;取最后一次洗滌液,加入KSCN溶液,若不出現紅色,則已洗凈,反之,未洗凈;
(2)根據氧化還原反應中電子得失守恒來分析;
(3)根據電子守恒建立關系式:Ce(OH)4~FeSO4,然后進行計算求出Ce(OH)4的質量,最后求出質量分數.
解答 解:(1)CeO2、SiO2、Fe2O3等中加入稀鹽酸,Fe2O3轉化FeCl3,化學方程式是Fe2O3+6HCl═2FeCl3+3H2O;取最后一次洗滌液,加入KSCN溶液,若不出現紅色,則已洗凈,反之,未洗凈;
故答案為:Fe2O3+6HCl═2FeCl3+3H2O;取最后一次洗滌液,加入KSCN溶液,若不出現紅色,則已洗凈,反之,未洗凈;
(2)稀硫酸、H2O2,CeO2三者反應生成轉化為Ce2(SO4)3、O2和H2O,反應的離子方程式為:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;
故答案為:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;
(3)Ce(OH)4 ~FeSO4
0.002mol 0.1000mol/L-1×0.02L
所以m(Ce(OH)4)=0.002mol×208g/mol=0.416g,產品中Ce(OH)4的質量分數為$\frac{0.416}{0.5}$×100%=80.3%,
故答案為:80.3%.
點評 本題以工藝流程為基礎,考察化學實驗基本操作、元素及化合物知識、化學計算、氧化還原反應等相關知識.


科目:高中化學 來源: 題型:選擇題
| A. | 溴苯中混有Br2,將其倒入NaOH溶液中,振蕩,靜置,分液 | |
| B. | 乙烷中混有乙烯,在一定條件下通入足量的氫氣進行反應,使乙烯轉化為乙烷 | |
| C. | 乙酸乙酯中混有乙酸,可加入一定量的乙醇,在濃硫酸存在的條件下加熱使乙酸酯化 | |
| D. | 乙烯中混有SO2和CO2,將其通入溴水進行洗氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只含1個碳碳雙鍵的直鏈有機物 | B. | 含2個碳碳雙鍵的直鏈有機物 | ||
| C. | 含1個碳碳雙鍵的環狀有機物 | D. | 含1個碳碳三鍵的直鏈有機物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
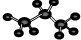


| A. | ①④ | B. | ①②④ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S原子的結構示意圖: | |
| B. | 氯化鈉的電子式: | |
| C. | 乙醇的結構式: | |
| D. | 硫酸的電離方程式:HSO4=H2++SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com