
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-數目為2NA | |
| B. | 含1molH2SO4的濃硫酸和足量的鋅完全反應,轉移的電子數為2NA | |
| C. | 1mol Mg在空氣中完全燃燒生成MgO和Mg3N2,失去2NA個電子 | |
| D. | 某密閉容器盛有0.1molN2,0.3molH2,在一定條件下反應,轉移的電子數為0.6NA |
分析 A、溶液體積不明確;
B、Zn與濃硫酸反應的離子方程式為Zn+SO42-+4H+=Zn2++SO2↑+2H2O,隨著反應的進行,硫酸濃度逐漸降低,當為稀硫酸時,發生Zn+2H+=ZnSO4+H2↑,根據參與反應的H+的物質的量與轉移電子的物質的量之間的對應關系來分析;
C、根據反應后鎂元素的化合價來分析;
D、合成氨的反應為可逆反應.
解答 解:A、溶液體積不明確,故溶液中ClO-的個數無法計算,故A錯誤;
B、Zn與濃硫酸反應的離子方程式Zn+SO42-+4H+=Zn2++SO2↑+2H2O可知,H+先反應完,且4molH+參與反應時轉移2mol電子,故如果1mol濃硫酸與鋅均按此反應進行,則轉移的電子為1mol;當為稀硫酸時,發生Zn+2H+=ZnSO4+H2↑,而此反應中,2molH+參與反應時轉移2mol電子,故如果1molH2SO4均和鋅按此反應進行,則轉移2mol電子;而含1molH2SO4的濃硫酸和足量的鋅反應時,硫酸濃度逐漸降低,故轉移的電子應介于1mol-2mol之間,故B錯誤;
C、反應后鎂元素的化合價為+2價,故1mol鎂轉移2mol電子,失去2NA個電子,故C正確;
D、合成氨的反應為可逆反應,不能進行徹底,故反應轉移的電子數小于0.1NA個,故D錯誤.
故選C.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

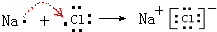 、
、 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:填空題
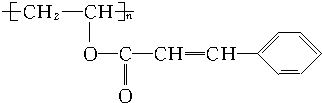
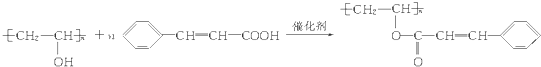 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  苯乙烯 苯乙烯 | B. | 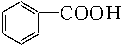 苯甲酸 苯甲酸 | C. | 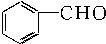 苯甲醛 苯甲醛 | D. |  苯乙酮 苯乙酮 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知25℃時部分弱電解質的電離平衡常數數據如表所示:
已知25℃時部分弱電解質的電離平衡常數數據如表所示:| 化學式 | CH3COOH | H2CO3 | HClO | |
| 電離平衡常數 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaNO2發生氧化反應 | |
| B. | NH4Cl 中的氮元素被還原 | |
| C. | N2既是氧化產物,又是還原產物 | |
| D. | 每生成1mol N2轉移電子的物質的量為6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E五種元素的原子序數依次增大,A元素位于周期表的s區,其原子中電子層數等于未成對電子數;B的基態原子中電子占據三種能量不同的原子軌道,且每種原子軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數之比為1:1的化合物N是常見的有機溶劑.E是有“生物金屬”之稱,E4+和氬原子的核外電子排布相同.
已知A、B、C、D、E五種元素的原子序數依次增大,A元素位于周期表的s區,其原子中電子層數等于未成對電子數;B的基態原子中電子占據三種能量不同的原子軌道,且每種原子軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數之比為1:1的化合物N是常見的有機溶劑.E是有“生物金屬”之稱,E4+和氬原子的核外電子排布相同. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com