
| A. | 當SO3的生成速率與SO2的消耗速率相等時反應達到平衡 | |
| B. | 降低溫度,正反應速率減小,而逆反應速率增大 | |
| C. | 將平衡混合氣體通入過量BaCl2溶液中,得到沉淀的質量為161.980 g | |
| D. | 達到平衡時,SO2的轉化率是90% |
分析 A.SO3的生成速率與SO2的消耗速率均表示正反應速率,反應始終按該比例關系進行;
B.降低溫度,正、逆反應速率都減小;
C.設二氧化硫起始物質的量是xmol,平衡時轉化的二氧化硫為ymol,則:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):x 1.1 0
轉化量(mol):y 0.5y y
平衡量(mol):x-y 1.1-0.5y y
氣體總物質的量減少0.315mol時反應達到平衡,則0.5y=0.315,故y=0.63,
在相同的溫度下測得氣體壓強為反應前的82.5%,則$\frac{x+1.1-0.315}{x+1.1}$=82.5%,故x=0.7,
將混合氣體通入過量的氯化鋇溶液中,三氧化硫和氯化鋇溶液反應生成硫酸鋇沉淀,二氧化硫與氧氣、水反應生成硫酸,硫酸與氯化鋇反應生成硫酸鋇沉淀,0.7mol二氧化硫完全轉化消耗0.35mol氧氣,氧氣有剩余,根據硫元素守恒計算硫酸鋇質量;
D.達到平衡時,SO2的轉化率=$\frac{轉化的二氧化硫物質的量}{二氧化硫起始物質的量}$×100%.
解答 解:A.SO3的生成速率與SO2的消耗速率均表示正反應速率,反應始終按該比例關系進行,應是當SO3的生成速率與SO2的生成速率相等時反應達到平衡,故A錯誤;
B.降低溫度,正、逆反應速率都減小,故B錯誤;
C.設二氧化硫起始物質的量是xmol,平衡時轉化的二氧化硫為ymol,則:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):x 1.1 0
轉化量(mol):y 0.5y y
平衡量(mol):x-y 1.1-0.5y y
氣體總物質的量減少0.315mol時反應達到平衡,則0.5y=0.315,故y=0.63,
在相同的溫度下測得氣體壓強為反應前的82.5%,則$\frac{x+1.1-0.315}{x+1.1}$=82.5%,故x=0.7,
將混合氣體通入過量的氯化鋇溶液中,三氧化硫和氯化鋇溶液反應生成硫酸鋇沉淀,二氧化硫與氧氣、水反應生成硫酸,硫酸與氯化鋇反應生成硫酸鋇沉淀,0.7mol二氧化硫完全轉化消耗0.35mol氧氣,氧氣有剩余,根據硫元素守恒,硫酸鋇的物質的量是0.7mol,故其質量為0.7mol×233g/mol=163.1g,故C錯誤;
D.達到平衡時,SO2的轉化率=$\frac{0.63mol}{0.7mol}$×100%=90%,故D正確,
故選:D.
點評 本題考查了化學平衡平衡計算、平衡狀態判斷、反應速率影響因素等,C選項為易錯點,學生容易考慮三氧化硫和氯化鋇溶液反應生成硫酸鋇沉淀,二氧化硫和氯化鋇溶液不反應,忽略氧氣存在下二氧化硫與氧氣、水反應生成硫酸,硫酸與氯化鋇反應生成硫酸鋇沉淀.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2017屆廣西桂林十八中高三上10月月考化學試卷(解析版) 題型:選擇題
在兩份相同的Ba(OH)2溶液中,分別滴入物質的量濃度相等的H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如圖所示。下列分析不正確的是( )
A.①代表滴加H2SO4溶液的變化曲線
B.b點,溶液中大量 存在的離子是Na+、OH–
存在的離子是Na+、OH–
C.c點,兩溶液中含有相同量的OH–
D.a、d兩點對應的 溶液均顯中性
溶液均顯中性
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 時 數 據 | CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | a kJ | b kJ | c kJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
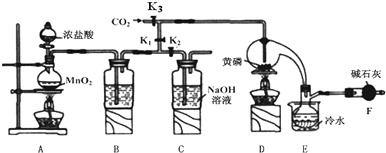
 的路線如圖所示.請按要求作答
的路線如圖所示.請按要求作答
 .
. ,F
,F .
. ,
, .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①用銅和濃硝酸制取少量NO2 | B. | ②比較S、C、Si的非金屬性 | ||
| C. | ③驗證HCl溶解性 | D. | ④用于吸收NH3尾氣,并防止倒吸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com