
下列氯化物中既能由單質直接化合制得,又可由金屬和鹽酸反應制得的是( )
A. CuCl2 B. FeCl2 C. FeCl3 D. AlCl3
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2017屆浙江省“七彩陽光”新高考研究聯盟高三下學期期初聯考化學試卷(解析版) 題型:選擇題
下列有關原電池的敘述中不正確的是
A. 原電池是將化學能轉化為電能的裝置
B. 在原電池中,電子流出的一極是負極,發生氧化反應
C. 鋅、銅、硫酸組成的原電池中,溶液中的 Zn2+、 H+均向正極移動
D. 構成原電池的兩個電極必須是活潑性不同的兩種金屬
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省邯鄲市高二下學期開學考試化學試卷(解析版) 題型:選擇題
某溫度下,向pH=6的蒸餾水中加入NaHSO4晶體,保持溫度不變,測得溶液的pH為2,下列對于該溶液的敘述不正確的是
A. 該溫度高于25℃
B. 由水電離出來的H+的濃度是1.0×10-12 mol·L-1
C. 加入NaHSO4晶體抑制了水的電離
D. c(H+)=c(OH-)+ c(SO42-)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省六安市高一上學期期末考試化學試卷(解析版) 題型:實驗題
氮化鋁(AlN)是一種新型無機非金屬材料,為了分析某AlN樣品(樣品中的雜質不與NaOH溶液反應)中AlN的含量,某實驗小組設計了如下兩種實驗方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的樣品,用以下裝置測定樣品中AlN的純度(夾持裝置已略去)。
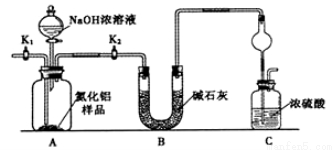
(1)上圖C裝置中球形干燥管的作用是________________________。
(2)完成以下實驗步驟:組裝好實驗裝置,首先檢查裝置的氣密性,再加入實驗藥品。接下來的實驗操作是________,打開分液漏斗活塞,加入NaOH濃溶液,至不再產生氣體。打開K1,通入氮氣一段時間,測定C裝置反應前后的質量變化。通入氮氣的目的是_______________。
(3)由于上述裝置還存在缺陷,導致測定結果偏高,請提出改進意見_________________。
【方案2】按以下步驟測定樣品中A1N的純度:
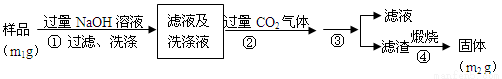
(4)步驟②生成沉淀的離子方程式為___________________。
(5)步驟③的操作是__________。A1N的純度是___________(用m1、m2表示)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省六安市高一上學期期末考試化學試卷(解析版) 題型:選擇題
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氫氧化鈉的溶液加熱,恰好使NH4+完全轉化為NH3逸出,另取一份加入含bmolHCl的鹽酸恰好反應完全,則該混合溶液中c(Na+)為( )
A. (2b-a)mol/L B. (10b-5a)mol/L C. (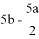 )mol/L D. (
)mol/L D. ( 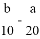 ) mol/L
) mol/L
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省六安市高一上學期期末考試化學試卷(解析版) 題型:選擇題
用下列裝置進行相應實臉,不夠達到實驗目的的是( )
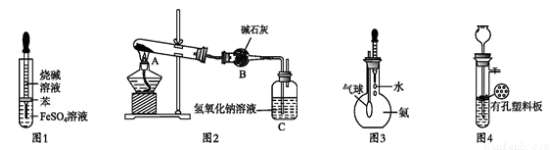
A. 圖1所示裝置可用于制備氫氧化亞鐵
B. 圖2所示裝置可用于測定Na2CO3和NaHCO3混合物中NaHCO3的含量
C. 圖3所示裝置可用于檢驗氨氣溶于水后顯堿性
D. 圖1所示裝置可用于CaCO3和稀鹽酸反應制取少量的CO2氣體
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省嘉峪關市高二上學期期末考試化學試卷(解析版) 題型:簡答題
已知在25℃時,Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.0×10-20
(1)在25℃時,向0.02mol/L的MgCl2溶液中加入NaOH固體,如果生成Mg(OH)2沉淀,應使溶液中的c(OH-)最小為______mol/L;
(2)在25℃時,向濃度均為0.02mol/L的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成______沉淀(填化學式);生成該沉淀的離子方程式為_______;當兩種沉淀共存時,c(Mg2+)/c(Cu2+)=________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省嘉峪關市高二上學期期末考試化學試卷(解析版) 題型:選擇題
下列說法中有明顯錯誤的是( )
A. 對有氣體參加的化學反應,增大壓強體系體積減小,可使單位體積內活化分子數增加,因而反應速率增大
B. 升高溫度,一般可使活化分子的百分數增大,因而反應速率增大
C. 有效碰撞一定在活化分子之間,活化分子之間發生的碰撞一定為有效碰撞
D. 加入適宜的催化劑,可使活化分子的百分數大大增加,從而成千上萬倍地增大化學反應的速率
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省新余市高二下學期入學考試化學試卷(解析版) 題型:實驗題
綠礬(FeSO4 • 7H2O)是治療缺鐵性貧血的特效藥.下面是以商品級純度鐵屑(含少量錫等雜質)生產綠礬的一種方法:

已知:在H2S飽和溶液中,SnS沉淀完全時溶液的pH為1.6;FeS開始沉淀時溶液的pH 為3.0,沉淀完全時的pH為5.5:
回答下列問題:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氫至飽和的目的是:
①除去操作I所得溶液中含有的Sn2+等雜質離子;
②____________________________;
③____________________________。
(2)操作IV的順序依次為:_______________、_______________、過濾、洗滌。
(3)操作IV得到的綠礬晶體用少量冰水洗滌,其目的是:
①除去晶體表面附著的硫酸等雜質;②___________________。
(4)測定綠礬產品中Fe2+ 含量的方法是:a.稱取8.680g綠礬產品,溶解,在250mL容量瓶中定容;b.量取25.00mL待測溶液于錐形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至終點,消耗KMnO4溶液體積的平均值為30.00 mL(滴定時發生反應的離子方程式為:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①計算上述樣品中FeSO4 • 7H2O的質量分數為_________________(結果保留4位有效數字,FeSO4 • 7H2O的摩爾質量為 278g/mol)
②若用上述方法測定的樣品中FeSO4•7H2O的質量分數偏低(測定過程中產生的誤差可忽略),其可能原因有:樣品中存在少量的雜質、___________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com