
分析 根據物質的性質選擇鑒別方法,四組物質中SO2具有漂白性,可使品紅褪色,乙烯可與溴發生加成反應,Na和K的焰色反應現象不同,鹽酸可與硝酸銀反應生成白色沉淀,以此解答該題.
解答 解:①SO2具有漂白性,可使品紅褪色,可用品紅鑒別;
②C2H4可與溴發生加成反應,可用溴的四氯化碳溶液鑒別;
③HCl溶液和NaNO3溶液加入硝酸銀溶液,HCl溶液可生成白色沉淀;
④NaCl溶液和KCl溶液,Na和K的焰色反應現象不同,可用焰色反應鑒別.
故答案為:①;②;③;④.
點評 本題考查物質的鑒別,側重于學生的分析能力和實驗能力的考查,為高考常見題型和高頻考點,注意相關基礎知識的積累,難度不大.


科目:高中化學 來源: 題型:解答題
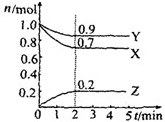 某溫度時在2L容器中X、Y、Z三種氣體物質的物質的量(n)隨時間(t)變化的曲線如右圖所示,由圖中數據分析:
某溫度時在2L容器中X、Y、Z三種氣體物質的物質的量(n)隨時間(t)變化的曲線如右圖所示,由圖中數據分析:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{2a}{3V}$mol/L | B. | $\frac{a}{3V}$mol/L | C. | $\frac{a}{6V}$mol/L | D. | $\frac{a}{4V}$mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL2% H2O2溶液 | 無 |
| ② | 10mL5% H2O2溶液 | 無 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅是正極,銅是負極 | B. | H+在溶液里流向鋅片 | ||
| C. | 負極發生還原反應 | D. | 電子經外電路由鋅流向銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
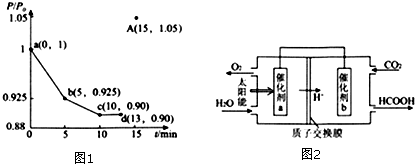
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
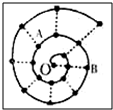 某同學在研究前18號元素時發現,可以將它們排成如圖所示的“蝸牛”形狀,圖中每個弧線上的“•”代表一種元素,其中O點代表氫元素.下列說法中正確的是( )
某同學在研究前18號元素時發現,可以將它們排成如圖所示的“蝸牛”形狀,圖中每個弧線上的“•”代表一種元素,其中O點代表氫元素.下列說法中正確的是( )| A. | 離O點越遠的元素越容易失去電子 | |
| B. | 虛線相連的元素處于同一周期 | |
| C. | B元素是圖中原子半徑最大的主族元素 | |
| D. | 元素O和A可形成多種化合物、和B不能形成化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com