
| ||
| ||
| ||
| ||
| 2 |
| 5 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 5 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 5 |
| ||
| ||
| 2 |
| 5 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 3 |
| 3 |
| 2 |
| ||
| 3 |
| 2 |


科目:高中化學 來源: 題型:
| A、NaCl |
| B、Na2C03 |
| C、NaOH |
| D、CH3COONa |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、乙烷與Cl2在光照下反應,每有NA個氫原子被氯替代,需消耗標準狀況下Cl2 11.2L |
| B、1mol苯中含有3NA個碳碳雙鍵 |
| C、14g乙烯和丙烯的混合物中含有3NA對共用電子對 |
| D、標準狀況下,22.4L己烷中的碳原子數為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
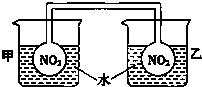 利用NO2平衡氣體遇熱顏色加深、遇冷顏色變淺來指示放熱過程和吸熱過程.
利用NO2平衡氣體遇熱顏色加深、遇冷顏色變淺來指示放熱過程和吸熱過程.查看答案和解析>>
科目:高中化學 來源: 題型:
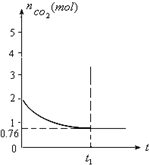 一定溫度下2升的恒容容器甲中,加入2moL碳和2moLCO2發生如下反應:
一定溫度下2升的恒容容器甲中,加入2moL碳和2moLCO2發生如下反應:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、溶液中溶質微粒作有規律的運動,膠體粒子運動無規律 |
| B、溶液中溶質微粒一定不帶電,膠體中分散質微粒帶電荷 |
| C、溶液中通過一束光,無特殊現象,而膠體中有“光亮的通路” |
| D、溶液呈電中性,膠體帶有電荷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com