
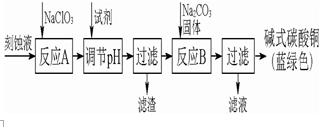
 堿式碳酸銅是一種用途廣泛的化工原料.工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制備,其制備過程如圖圖所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
堿式碳酸銅是一種用途廣泛的化工原料.工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制備,其制備過程如圖圖所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
分析 由制備流程可知,廢液中加入次氯酸鈉將亞鐵離子氧化成鐵離子,然后用氫氧化銅或碳酸銅調節溶液的pH生成氫氧化鐵除去鐵離子,過濾后加入碳酸鈉溶液生成堿式碳酸銅,過濾后得到堿式碳酸銅,
(1)亞鐵離子不容易除去,需要加入次氯酸鈉將亞鐵離子氧化成鐵離子,便于除去雜質;
(2)調節pH使得鐵離子沉淀完全,而銅離子不能開始沉淀,為了不引入雜質,最合適的物質如CuO、碳酸銅;
(3)反應B的溫度如過高,碳酸銅和氧化銅受熱分解為氧化銅;
(4)取最后一次洗滌液設計實驗用硝酸酸化的硝酸銀溶液檢驗是否含有氯離子設計檢驗;
(5)①Cu2+和CO32-生成CuCO3沉淀;
②Cu2+和CO32-和水反應生成Cu(OH)2沉淀和二氧化碳.
解答 解:(1)由于沉淀氫氧化亞鐵的pH大于沉淀氫氧化鐵的pH,所以應該把亞鐵離子氧化生成鐵離子,然后再轉化為沉淀,所以氯酸鈉的作用是將Fe2+氧化成Fe3+,
濾渣為鐵離子完全沉淀得到的氫氧化鐵沉淀;
故答案為:將Fe2+氧化成Fe3+并最終除去;Fe(OH)3;
(2)調節pH使得鐵離子沉淀完全,而銅離子不能開始沉淀,調節反應A后溶液的pH范圍應為3.2-4.2;氨水、氫氧化鈉、MgO均引入雜質離子,為了不引入雜質,最合適的堿性物質是b、d,
故答案為:3.2-4.2;bd;
(3)反應B的溫度如過高,碳酸銅和氧化銅均可受熱分解生成氧化銅,故答案為:CuO;
(4)最后過濾得到的產品洗滌時,判斷產品已經洗凈的方法和步驟為:取最后一次洗滌液,加入硝酸銀和稀硝酸,無沉淀生成則表明已洗滌干凈;
故答案為:取最后一次洗滌液,加入硝酸銀和稀硝酸,無沉淀生成則表明已洗滌干凈;
(5)①將Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀,Cu2+和CO32-生成CuCO3沉淀,離子方程式為Cu2++CO32-=CuCO3↓,
故答案為:Cu2++CO32-=CuCO3↓;
②Cu2+和CO32-和水發生雙水解反應生成Cu(OH)2沉淀和二氧化碳,離子方程式為Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑,
故答案為:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑.
點評 本題考查物質的制備實驗,為高考常見題型,把握制備流程及發生的反應為解答的關鍵,側重于學生的分析能力和實驗能力的考查,注意氧化還原反應、鹽類水解及表格數據的應用,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳用于滅火 | B. | 氧氣供給呼吸 | ||
| C. | 金剛石用作鉆探機的鉆頭 | D. | 用鎂制作照明彈 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃度為0.1mol/L | B. | 濃度為1mol/L | C. | 含NaOH 4g | D. | 含NaOH 0.1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com