
 (Ⅰ)2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.請回答下列問題:
(Ⅰ)2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.請回答下列問題:| 7 |
| 10 |
| P平衡 |
| P開始 |
| n平衡 |
| n開始 |
| ||
| P開始 |
| 3-x |
| 3 |
| [SO3]2 |
| [SO2]2?[O2] |
[
| ||||
[
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
| A、Al→Al2O3→Al(OH)3→NaAlO2 |
| B、Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
| C、N2→NO→NO2→HNO3 |
| D、S→SO3→H2SO4→MgSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
A、NF3的形成過程用電子式可表示為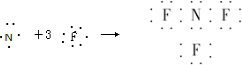 |
| B、NF3的氧化性大于F2 |
| C、NF3分子空間構型為三角錐形 |
| D、NH4F中既有離子鍵又有極性共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為40%,且其核內質子數等子中子數.R是由A、D兩元素形成的離子化合物,其中A+與D2-離子數之比為2:1.諳冋答下列問題:
有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為40%,且其核內質子數等子中子數.R是由A、D兩元素形成的離子化合物,其中A+與D2-離子數之比為2:1.諳冋答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
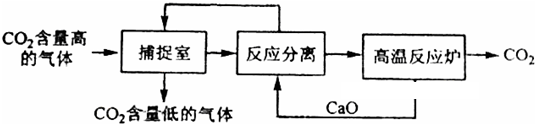
查看答案和解析>>
科目:高中化學 來源: 題型:
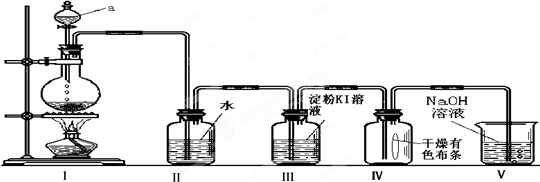
查看答案和解析>>
科目:高中化學 來源: 題型:
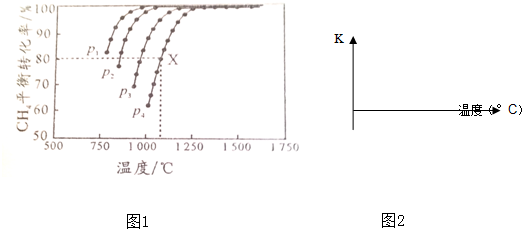 .
.查看答案和解析>>
科目:高中化學 來源: 題型:
周期 族 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
查看答案和解析>>
科目:高中化學 來源: 題型:
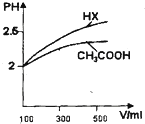 已知25℃時部分弱電解質的電離平衡常數數據如下表
已知25℃時部分弱電解質的電離平衡常數數據如下表| 化學式 | 電離常數(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.0×10-2、Ka2=1.02×10-7 |
| c(H2SO3) |
| c(HSO3-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com