
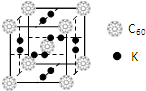
 氫氣作為一種清潔能源,必須解決它的儲存問題,C60可用作儲氫材料.
氫氣作為一種清潔能源,必須解決它的儲存問題,C60可用作儲氫材料.分析 (1)根據分子晶體的熔點與共價鍵的鍵能無關;
(2)根據電子排布規律,寫出鉀原子電子排布式;根據晶胞的分配原則計算出每個晶胞結構各離子的個數;
(3)根據同一周期,同一主族,元素電負性變化規律,比較元素電負性大小;根據每個硅原子最外層才滿足8電子穩定結構,得出每個硅原子只有$\frac{1}{2}$個π鍵.
解答 解:(1)盡管C60中C-C鍵的鍵能可能大于金剛石,但其熔化時并不破壞化學鍵,因此比較鍵能沒有意義,
故答案:不正確,C60是分子晶體,熔化時不需破壞化學鍵;
(2)在晶胞中,每個面上有兩個鉀原子,每個頂點上和體心有一個C60,根據均攤法可知K原子個數為6×2×$\frac{1}{2}$=6,C60分子的個數比為8×$\frac{1}{8}$+1=2;所以K原子個數為和C60分子的個數比為6:2=3:1,故答案:3:1;
(3)同一周期,從左到右,電負性逐漸增大,同一主族,從上到下,電負性逐漸減小,因此,原子電負性由大到小的順序是:N>C>Si,根據題意,每個硅形成的這3個鍵中,必然有1個雙鍵,這樣每個硅原子最外層才滿足8電子穩定結構.顯然,雙鍵數應該是Si原子數的一半,而每個雙鍵有1個π鍵,顯然π鍵數目為30.
故答案:N>C>Si;30.
點評 本題主要考查了元素周期律、化學鍵、分子間作用力、晶胞的計算等知識,有一定的綜合性,中等難度.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
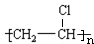 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
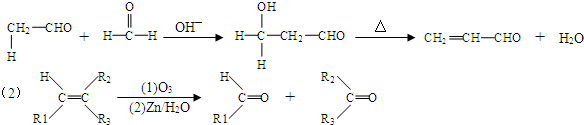
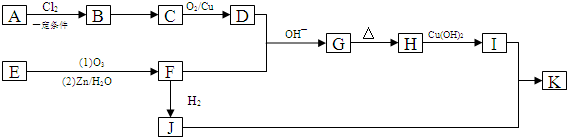
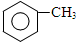 ,B→C的反應類型為:取代反應
,B→C的反應類型為:取代反應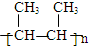
 +O2$→_{△}^{Cu}$ 2
+O2$→_{△}^{Cu}$ 2 +H2O;I+J→K:
+H2O;I+J→K: +CH3CH2OH$→_{△}^{濃硫酸}$
+CH3CH2OH$→_{△}^{濃硫酸}$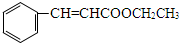 +H2O
+H2O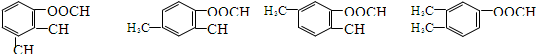 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,屬于離子化合物.
,屬于離子化合物. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 采用原煤脫硫技術,可減少燃煤產生的SO2,從而有效降低酸雨的產生和危害 | |
| B. | FeCl2、CuS、SO3、NO2都不能由單質間直接化合得到 | |
| C. | SO2既可以由硫的化合物氧化得到,又可以由硫的化合物還原得到 | |
| D. | 硫為不溶于水,易溶于酒精和CS2的黃色粉末 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 據反應①可知N2的燃燒熱為180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反應②在恒溫恒容密閉容器反應達平衡后,充入N2,平衡正向移動,氮氣的轉化率減小,該反應的平衡常數增加 | |
| D. | 可推知,氨的催化氧化的熱化學方程式為4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 從CH4、NH4+、SO42-為正四面體結構,可推測PH4+、PO43-也為正四面體結構 | |
| B. | NaCl與CsCl化學式相似,故NaCl與CsCl的晶體結構也相似 | |
| C. | 苯不能使酸性高錳酸鉀溶液褪色,故苯的同系物也不能使酸性高錳酸鉀溶液褪色 | |
| D. | CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 金屬 | G | L | M | R |
| 和冷水反應 | 無反應 | 慢慢反應 | 未做 | 未做 |
| 和2mol/L HCl 反應 | 溶解并放出氣體 | 溶解并放出氣體 | 無反應 | 無反應 |
| 和Rn+的水溶液反應 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
| A. | L、G、R、M | B. | G、L、M、R | C. | L、G、M、R | D. | L、R、G、M |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com