
【題目】一種新型鎂儲備電池的儲存壽命長,電壓平穩,電池的總反應為Mg+Cu2Cl2=2Cu+MgCl2,以該電池為電源在銅片上鍍銀的實驗裝置如圖所示。

下列說法正確的是
A. 接通電路后,電池的正極質量減小
B. 若反應消耗1mol Mg,則有1mol Cl-通過陰離子交換膜
C. M電極材料為銅片
D. 接通電路后,AgNO3溶液的濃度減小
科目:高中化學 來源: 題型:
【題目】鎂、銅等金屬離子是人體內多種酶的輔因子。工業上從海水中提取鎂時,先制備無水氯化鎂,然后將其熔融電解,得到金屬鎂。
(1)以MgCl2為原料用熔融鹽電解法制備鎂時,常加入NaCl、KCl或CaCl2等金屬氯化物,其主要作用除了降低熔點之外還有________。
(2)已知MgO的晶體結構屬于NaCl型。某同學畫出的MgO晶胞結構示意圖如圖所示,請改正圖中錯誤:__________________。
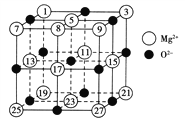
(3)Mg是第三周期元素,該周期部分元素氟化物的熔點見下表:
氟化物 | NaF | MgF2 | SiF4 |
熔點/K | 1 266 | 1 534 | 183 |
解釋表中氟化物熔點差異的原因:_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若ABn分子的中心原子上沒有孤對電子,應用價層電子對互斥模型理論,判斷下列說法正確的是
A. n=3時,則分子的立體構型為V形
B. n=2時,則分子的立體構型平面三角形
C. n=4時,則分子的立體構型為正四面體形
D. n=4時,則分子的立體構型為三角錐形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.5 L 1 mol/L FeCl3溶液與3 L 0.5 mol/L KCl溶液中的Cl-的數目之比
A.1:6B.1:1C.2:1D.3:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】B元素和N元素對植物生長及人體健康有著十分重要的作用,也廣泛應用于新型材料的制備。
(1)基態氮原子的外圍電子排布圖為________________;晶體硼單質的基本結構單元為正二十面體,其能自發地呈現多面體外形,這種性質稱為晶體的__________________性。
(2)氨硼烷(NH3BH3)被認為是最具潛力的新型儲氫材料之一,與氨硼烷互為等電子體的分子、離子的化學式分別是______________、________________。 (各舉一例),第二周期元素中第一電離能介于B和N之間的元素是______________(填元素符號)。
(3)血紅素是吡咯(C4H5N)的重要衍生物,血紅素(含Fe2+)可用于治療缺鐵性貧血。吡咯和血紅素的結構如下圖:

①己知吡咯中的各個原子均在同一平面內;則吡咯分子中N原子的雜化類型為________________。
②1mol吡咯分子中所含的σ鍵總數為__________個;分子中的大π鍵可用Π![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數,則吡咯環中的大π鍵應表示為____________。
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數,則吡咯環中的大π鍵應表示為____________。
③C、N、O三種元素的簡單氫化物鍵角由小到大的順序為_____________(填化學式),原因是__________________。
④血液中的O2是由血紅素在人體內形成的血紅蛋白來輸送的,則血紅蛋白中的Fe2+與O2是通過___________鍵相結合。
(4)氮化硼(BN)是受高度關注的耐磨材料,可作為金屬表面的保護層,其結構與金剛石類似,晶胞結構如圖所示。已知該晶體密度為ag/cm3,根據硬球接觸模型計算晶體中兩個最近的N原子間的距離為:_________pm。(用含a的代數式表示,NA表示阿伏加德羅常數)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家發現C60分子由60個碳原子構成,它的形狀像足球(圖丙),含有![]() 鍵,因此又叫足球烯。1991年科學家又發現一種碳的單質——碳納米管,是由六邊環形的碳原子構成的具有很大表面積管狀大分子(圖丁),圖甲、圖乙分別是金剛石和石墨的結構示意圖。圖中小黑點均代表碳原子。
鍵,因此又叫足球烯。1991年科學家又發現一種碳的單質——碳納米管,是由六邊環形的碳原子構成的具有很大表面積管狀大分子(圖丁),圖甲、圖乙分別是金剛石和石墨的結構示意圖。圖中小黑點均代表碳原子。
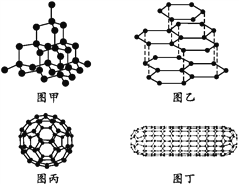
(1)金剛石、石墨、足球烯和碳納米管四種物質互稱為同素異形體,它們在物理性質上存在較大的差異,其原因是____。
(2)同條件下,足球烯、石墨分別和氣體單質F2反應時,化學性質活潑性的比較為足球烯比石墨____(填“活潑”“一樣活潑”或“更不活潑”),理由是___。
(3)由圖中石墨的晶體結構俯視圖可推算在石墨晶體中,每個正六邊形平均所占有的C原子數與C—C鍵數之比為____。
(4)在金剛石的網狀結構中,含有共價鍵形成的碳原子環,其中最小的環上有____個碳原子(填數字),每個碳原子上的任兩個C—C鍵的夾角都是____(填角度)。
(5)燃氫汽車之所以尚未大面積推廣,除較經濟的制氫方法尚未完全解決外,還需解決H2的貯存問題,上述四種碳單質中有可能成為貯氫材料的是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E、F都是元素周期表前四周期的元素,它們的核電荷數:B<A<C<D<E<F。B、C兩種元素都能引起水體富營養化。E原子得到一個電子后3p軌道全充滿。A+比E原子形成的離子少1個電子層。D可以形成兩種氧化物,其中一種氧化物是形成酸雨的主要氣體之一。F的原子序數為26。請回答下列問題:
(1)C、D、E的第一電離能由小到大的順序為________(用元素符號表示)。
(2)寫出B的氫化物與水反應的離子方程式:________________,B的氫化物極易溶于水的原因是____________________________________________________________。
(3)化合物BE3的分子空間構型為________________。
(4)F元素原子的核外電子排布式為________。F的一種常見化合物F(CO)5在常溫下呈液態,熔點為-20.5℃,沸點為103℃,易溶于非極性溶劑,則F(CO)5的晶體類型為__________________。
(5)將FE3的飽和溶液滴入沸水中,請寫出有關反應的離子方程式:___________________________。
(6)比較B、C兩種元素的氫化物穩定性并說明理由:____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 下列事實不能用勒夏特列原理解釋的是 ( )
A.合成氨工業上增大壓強以提高反應物的轉化率
B.黃綠色的氯水光照后顏色變淺
C.由H2、I2蒸氣、HI組成的平衡體系加壓后顏色變深
D.在含有Fe(SCN)2+的紅色溶液中加鐵粉,振蕩靜置,溶液顏色變淺或褪去
查看答案和解析>>
科目:高中化學 來源: 題型:
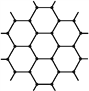
【題目】下列結構圖中,●代表前二周期元素的原子實(原子實是原子除去最外層電子后剩余的部分),小黑點代表未用于形成共價鍵的最外層電子,短線代表價鍵。示例:(圖中F2)根據各圖表示的結構特點,下列有關敘述正確的是( )

A. 上述結構圖中共出現6種元素 B. 甲、乙、丙為非極性分子,丁為極性分子
C. 甲與丁可以發生化合反應生成離子化合物 D. 向CaCl2溶液中通入丙有白色沉淀產生
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com