
| A. | 已知酸性H2SO3>HClO>HSO3-,則向Na2SO3溶液中加入HClO的離子方程式為:SO32-+HClO=HSO3-+ClO- | |
| B. | PH=3的HClO溶液,加水稀釋后,溶液中所有的離子濃度降低 | |
| C. | 在25°C時,次氯酸的電離方程式及熱效應可表示為:HClO(aq)?H+(aq)+ClO-(aq);△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 將20ml 1mol/L HClO溶液與10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
分析 A.次氯酸具有強氧化性與亞硫酸根離子發生氧化還原反應;
B.依據Kw=C(H+)C(OH-)分析判斷;
C.依據蓋斯定律計算解答;
D.依據電荷守恒、物料守恒解答.
解答 解:A.向Na2SO3溶液中加入HClO的離子方程式為:SO32-+HClO=SO42-+H++Cl-,故A錯誤;
B.溫度不變,Kw不變,加水稀釋PH=3的HClO溶液,氫離子濃度減小,則氫氧根離子濃度升高,故B錯誤;
C.根據蓋斯定律,在25°C時,次氯酸的電離方程式及熱效應可表示為:HClO(aq)=H+(aq)+ClO-(aq)△H=-(Q1-57.3)kJ•mol-1,故C錯誤;
D.B、將20mL 1mol/L HClO與10mL 1mol/L NaOH混合后所得的溶液是等濃度的次氯酸和次氯酸鈉的混合物,根據電荷守恒:c(H+)+c(Na+)=c(OH-)+c(ClO-),根據物料守恒:2c(Na+)=c(ClO-)+c(HClO),整理兩個等式得到2c(H+)-2c(OH-)=c(ClO-)-c(HClO),故D正確;
故選:D.
點評 本題為綜合題,涉及離子方程式書寫,利用蓋斯定律計算反應熱,溶液中守恒定律的應用等,題目難度較大,掌握相關知識是解題關鍵.


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | NO3- | B. | Cu2+ | C. | Mg2+ | D. | Ba2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應的熱化學方程式為:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA個 O2(l)反應生成2mol NO(g)時,吸收的能量為180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的總能量小于2 mol NO(g)具有的總能量 | |
| D. | 通常情況下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
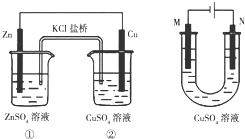
| A. | 裝置①將電能轉變為化學能 | |
| B. | 裝置①中鹽橋內的Cl-移向ZnSO4溶液 | |
| C. | 若裝置②用于鐵棒鍍銅,則N極為鐵棒 | |
| D. | 若裝置②用于電解精煉銅,則溶液中的Cu2+濃度保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| ① | ② | ③ | ④ | ⑤ |
| 物質微粒數 | 固體體積 | 溶液中溶質的質量分數 | 標準狀況下氣體的摩爾體積 | 非標準狀況下某物質的質量 |
| 阿伏加德羅常數 | 固體密度 | 溶液體積 | 標準狀況下氣體的體積 | 物質的摩爾質量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬單質的熔點隨原子序數的增大而降低 | |
| B. | 金屬元素的最外層電子數都小于4 | |
| C. | 已知硒(Se)位于第四周期第ⅥA族,其最高價氧化物對應水化物的化學式為H2SeO3 | |
| D. | 第二周期非金屬元素的氣態氫化物溶于水后,水溶液均為酸性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com