
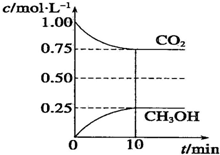
 在一定溫度下的2L固定容積的密閉容器中,通入2mol CO2和3mol H2,發生的反應為CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ.mol-1(a>0),測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示.
在一定溫度下的2L固定容積的密閉容器中,通入2mol CO2和3mol H2,發生的反應為CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ.mol-1(a>0),測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示.分析 (1)①平衡狀態的標志可以兩個方兩去判斷,一、是看正逆反應速是否相等,二是各組分的濃度和分數是否隨時間的改變而改變;也可以抓住未平衡時是個變量,現在不變說明已經達到平衡狀態了,來解決問題;
(2)計算二氧化碳的反應速率,結合速率之比等于化學方程式計量數之比計算氫氣的反應速率v=$\frac{△c}{△t}$計算得到;
(3)根據外界條件的改變來判斷平衡移動方向,然后去分析分子和分母的變化情況;
(4)用三行式來求平衡時的各組分濃度,然后代入平衡常數表達式求解,要注意代入平衡常數表達式是平衡濃度,平衡常數是溫度的函數,溫度變平衡常數才變,到底如何變,還要看反應的熱效應;
解答 解:(1)①未平衡時是個變量,現在不變說明已經達到平衡狀態了,
A.未平衡CO2的體積分數是個變化的量,現在混合氣體CO2的體積分數保持不變,說明已經平衡了,故A正確;
B.未平衡時混合氣體的平均相對分子質量是個變化的量,現在不隨時間的變化而變化,說明已經達平衡狀態,故B正確;
C.單位時間內每消耗1.2mol H2,向正方向,同時生成0.4mol H2O,也向正方向,不能反映正逆反應之間的關系,故C錯誤;
D.反應中H2O與CH3OH的物質的量濃度之比為1:1,且保持不變,不能說明各自的量不再隨時間的變化而變化,故C錯誤;
故選AB;
(2)從0min到10min,v(CO2)=$\frac{1.0mol/L-0.75mol/L}{10min}$=0.025mol/L•s,v(H2)=3v(CO2)=0.025mol/L•s×3=0.075mol/L•s,
故答案為:0.075 mol•L-1•min-1;
(3)A.升高溫度,平衡逆向移動,故比值減小,故A不選;
B.恒溫恒容下充入He(g),平衡不移動,故比值不變,故B不選;
C.將H2O(g)從體系中分離,平衡正向移動,故比值變大,故選C;
D.恒溫恒容再充入2mol CO2和3mol H2,相當于增大壓強,平衡正向移動,故比值變大,故選D;
故答案為CD;
(4)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
變化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,
而平衡常數是溫度的函數,只有通過改變溫度來改變平衡常數,正反應量放熱反應,降低溫度,K值變大,
故答案為:0.20;D.
點評 本題考查了化學平衡的有關知識,學生要學會三行式在解題中的應用,綜合性強,但難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
 如圖所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和鹽酸時,沉淀的物質的量y(mol)與加入NaOH溶和鹽酸的體積x(mL)的關系圖.根據圖示判斷,下列結論中不正確的是( )
如圖所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和鹽酸時,沉淀的物質的量y(mol)與加入NaOH溶和鹽酸的體積x(mL)的關系圖.根據圖示判斷,下列結論中不正確的是( )| A. | N點時溶液中的溶質只有NaCl | |
| B. | 原混合溶液中c(MgCl2):c(AlCl3)=1:2 | |
| C. | c(NaOH)=c(HCl) | |
| D. | M點之前加入的是NaOH溶液,M點之后加入的是鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 粗鹽過濾時,用玻璃棒攪拌加快過濾的速度 | |
| B. | 蒸發濾液時,待蒸發皿中濾液蒸干時停止加熱 | |
| C. | 配制溶液時必須使用的儀器有托盤天平、酒精燈、量筒、燒杯、玻璃棒等 | |
| D. | 配制溶液需要經過計算、稱量、溶解、裝瓶貼標簽等步驟 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 容器內氣體密度減小 | B. | 平衡向正反應方向移動 | ||
| C. | 二氧化氮的轉化率增大 | D. | 四氧化二氮的體積分數減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 .
.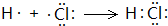 .
. ,尿素分子中σ鍵和π鍵數目之比為7:1.
,尿素分子中σ鍵和π鍵數目之比為7:1.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 需要加熱的化學反應都是吸熱反應 | |
| B. | 放熱反應都不需要加熱就可以發生 | |
| C. | 化學反應除了生成新物質外,還伴隨著能量的變化 | |
| D. | 化學反應放熱還是吸熱,取決于反應條件 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 熒光素屬于高分子化合物 | |
| B. | 熒光素與氧化熒光素都至少有6個碳原子共平面 | |
| C. | 熒光素與氧化熒光素都能與碳酸氫鈉反應 | |
| D. | 熒光素與氧化熒光素互為同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 葡萄糖、蔗糖、淀粉都可以食用,都能發生水解 | |
| B. | 苯與液溴在鐵作催化劑的條件下的反應為加成反應 | |
| C. | 甲烷、苯、淀粉、蛋白質完全燃燒的產物都只有二氧化碳和水 | |
| D. | 油脂屬于酯,在酸性條件下的水解產物都是醇和羧酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖為元素周期表的一部分,A、B、C均為短周期元素.B的最高價氧化物的水化物為H3BO4,則A、B、C依次是( )
如圖為元素周期表的一部分,A、B、C均為短周期元素.B的最高價氧化物的水化物為H3BO4,則A、B、C依次是( )| A. | C、A1、P | B. | N、Si、S | C. | C、P、O | D. | F、S、Ar |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com