
【題目】研究含硫物質的循環,是能源開發和利用的重要途徑之一。
(1)研究人員利用含硫物質熱化學循環實現太陽能的轉化與存儲,過程如下:
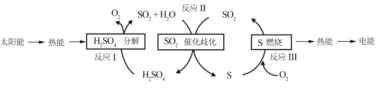
①反應Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反應Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反應Ⅱ的熱化學方程式為________。
②對于反應Ⅱ,將投料比(n(SO2):n(H2O))為 3:2 的混合氣體充入恒容的密閉容器中, 在不同壓強下,H2SO4 在平衡體系中物質的量分數隨溫度的變化關系如下圖所示。下列說法不正確的是___
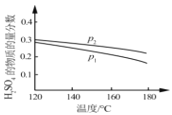
A.p2>p1,反應Ⅱ的ΔS < 0
B.使用合適催化劑可以提高 H2SO4 在平衡體系中物質的量分數
C.其他條件相同時,投料比(n(SO2):n(H2O))改變為 2:1,可提高 SO2 的平衡轉化率
D.當容器內氣體的密度不變時,可判斷反應達到平衡狀態
E.溫度升高,有利于反應速率加快,SO2 的平衡轉化率提高,K 值變小
(2)“硫碘循環”法是分解水制氫氣的研究熱點,涉及下列三個反應:
反應A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反應B:2HI(g) H2(g) + I2(g)
反應C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某溫度下將 1mol HI 充入密閉容器中發生反應B,達到第 1 次平衡后,用選擇性膜完全分離出 H2,達到第 2 次平衡后再次分離H2,重復多次,平衡時 n(HI)如下表:
達到平衡的次數 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
歸納出分離 H2 的次數對 HI 轉化率的影響________。第 2 次平衡時 I2 的物質的量為 n(I2)=_____mol;
②反應 A 發生時,溶液中同時存在以下化學平衡: I2(aq) + I(aq)![]() (aq),其反應速率極快且平衡常數很大。現將 1mol SO2 緩緩通入含 1 mol I2 的水溶液中恰好完全反應。請在下圖中畫出溶液中
(aq),其反應速率極快且平衡常數很大。現將 1mol SO2 緩緩通入含 1 mol I2 的水溶液中恰好完全反應。請在下圖中畫出溶液中![]() 的物質的量 n( I3- )隨反應時間 t 變化的曲線圖____。
的物質的量 n( I3- )隨反應時間 t 變化的曲線圖____。

【答案】3SO2(g)+2H2O (g)=2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1 BCE 隨著分離 H2次數的增加,HI的轉化率逐漸提高,但提高幅度逐漸減小 0.165 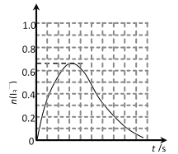 (最高點為 0.67)
(最高點為 0.67)
【解析】
根據蓋斯定律分析判斷即可;結合影響平衡移動的因素分析,注意催化劑不改變平衡移動;根據減小生成物的濃度促進平衡正向移動分析。
(1)①反應Ⅰ:2H2SO4(l)═2SO2(g)+2H2O(g)+O2(g)△H1=+551kJmol-1,反應Ⅲ:S(s)+O2(g)═SO2(g)△H3=-297kJmol-1,結合蓋斯定律可知,-I-III得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),其△H=-(+551kJmol-1)-(-297kJmol-1)=-254kJ/mol,則反應Ⅱ的熱化學方程式為3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)△H=-254kJ/mol;
②A.增大壓強平衡正向移動,硫酸的物質的量增大,由圖可知,p2對應硫酸物質的量分數大,則p2>pl;反應Ⅱ為氣體體積減小的反應,則△S<0,故A正確;
B.催化劑對平衡移動無影響,則催化劑不能提高H2SO4在平衡體系中物質的量分數,故B錯誤;
C.投料比【n(SO2):n(H2O)】改變為2:1,對比投料比【n(SO2):n(H2O)】為3:2時,相當于增大二氧化硫的物質的量,促進水的轉化,但SO2的平衡轉化率減小,故C錯誤;
D.氣體的體積一定,混合氣體的總質量不確定,當容器內氣體的密度不變時,說明混合氣體總質量一定,則可判斷反應達到平衡狀態,故D正確;
E.反應Ⅱ為放熱反應,溫度升高,有利于反應速率加快,但平衡逆向移動,SO2的平衡轉化率降低,K 值變小,故E錯誤;
故答案為BCE;
(2)①分離出氫氣,有利于平衡向正反應方向移動,隨著分離氫氣次數的增加,HI的轉化率逐漸提高,但提高幅度逐漸減小;
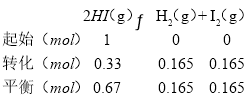
故2次平衡時I2的物質的量為n(I2)=0.165mol;
②將SO2的通入I2的水溶液,反應生成I-,生成的I-與I2結合得到I3-,隨反應進行I3-物質的量增大,由I原子守恒可知I3-的最大物質的量為![]() ≈0.67mol,繼續通入SO2,I2(aq)+I-(aq)
≈0.67mol,繼續通入SO2,I2(aq)+I-(aq)![]() I3-(aq)平衡向左移動,I3-物質的量減小,由SO2+I2+2H2O=2HI+H2SO4可知,二氧化硫與碘單質恰好完全反應,故最終I3-物質的量為0,溶液中I3-的物質的量n(I3-)隨反應時間t變化的曲線圖為:
I3-(aq)平衡向左移動,I3-物質的量減小,由SO2+I2+2H2O=2HI+H2SO4可知,二氧化硫與碘單質恰好完全反應,故最終I3-物質的量為0,溶液中I3-的物質的量n(I3-)隨反應時間t變化的曲線圖為: 。
。


科目:高中化學 來源: 題型:
【題目】常溫下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH環境下不同形態的粒子組成分數如圖所示,下列說法正確的是
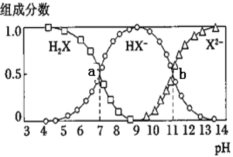
A.水的電離程度:b點小于點a
B.將等物質的量的NaHX、Na2X溶于水中,所得溶液pH恰好為11
C.常溫下的Ka(HY)=1.1×10-10,將少量H2X溶液加入到足量NaY溶液中,發生的反應為:H2X+Y-=HY+HX-
D.常溫下,反應X2-+H2OHX-+OH-的平衡常數對數值1gK=-11
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.0.1molL-1CH3COOH溶液加水稀釋,CH3COO-數目增多,c(OH-)增大
B.室溫下,NaHSO3溶液的pH<7,說明![]() 的電離程度大于其水解程度
的電離程度大于其水解程度
C.酸堿質子理論認為,凡能給出質子(H+)的物質都是酸,凡能接受質子的物質都是堿。由該理論可知:NaHCO3、H2O、Al(OH)3均可稱為酸堿兩性物質
D.25℃時0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,當溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S)時,溶液的主要溶質為Na2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將amol氮氣與bmol氫氣的混合氣體通入一個固定容積的密閉容器中,發生反應N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反應進行到某時刻t時,nt(N2)=13 mol,nt(NH3)=6 mol,則a值為________。
(2)反應達到平衡時,混合氣體的體積為716.8 L(標準狀況下),其中氨氣體積分數為25%,平衡時氨氣的物質的量為________。
(3)原混合氣體與平衡混合氣體的總物質的量之比(寫最簡整數比,下同)n始∶n平=________。
(4)原氣體中a∶b=________。
(5)達到平衡時,N2和H2的轉化率之比α(N2)∶α(H2)=________。
(6)達到平衡時混合氣體中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種重要的殺菌消毒劑。以氯酸鈉(NaC1O3)為原料 制備NaC1O2粗品的工藝流程如下圖所示。

己知:①純C1O2易分解爆炸,空氣中C1O2的體積分數在10%以下比較安全。
②NaClO2高于60°C會分解。
(1)反應I的離子方程式為____;反應中需同時鼓入空氣的主要目的是____ °
(2)“合成”過程中的氧化劑是______。
(3)蒸發時,需要減壓的目的是_____。
(4)“冷卻結晶”后獲得NaClO,粗產品的操作是_____(填操作名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】摩爾鹽[(NH4)2Fe(SO4)26H2O]是一種淺綠色晶體,廣泛應用于電鍍工業。為探 究其分解產物,某學習小組利用如圖所示裝置進行實驗。
(查閱資料)隔絕空氣加熱至500°C時,摩爾鹽能完全分解,分解產物中有鐵氧化物, 硫氧化物,氨氣和水蒸氣等。

(1)對A裝置加熱前,先通一段時間N2的目的是_______。
(2)實驗開始一段時間后,裝置B中的現象為______。
(3)實驗中觀察到裝置D始終無明顯現象,裝置C中和E中均產生白色沉淀。
①寫出E中SO2與H2O2發生反應的化學方程式:_______。
②甲同學根據C中產生白色沉淀現象判斷產物中一定含有SO3。請對甲同學的判斷作出評價,并說明理由:_____。
(4)實驗結束后,裝置A中的固體變為紅棕色,請補充完整檢驗該殘留固體中是否含 FeO或Fe3O4的實驗方案:取A中少量殘留固體,加入稀硫酸使其完全溶解,向 溶液中滴加 ________,若觀察到 ______,說明殘留固體中不含FeO和Fe3O4。(提供的試劑有:NaOH溶液、氯水、硫氰化鉀溶液、酸性高錳酸鉀溶液)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1100℃,一定容積的密閉容器中發生反應:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) △H=a kJ/mol(a >0),該溫度下K=0.263,下列有關該反應的說法正確的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),該溫度下K=0.263,下列有關該反應的說法正確的是( )
A. 若生成1 mol Fe,則吸收的熱量小于a kJ
B. 若升高溫度,正反應速率加快,逆反應速率減慢,則化學平衡正向移動
C. 若容器內壓強不隨時間變化,則可以判斷該反應已達到化學平衡狀態
D. 達到化學平衡狀態時,若c(CO)=0.100 mol/L,則c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷是一種清潔能源,下列有關說法正確的是( )
A.一定溫度下,反應CO2(g)+4H2(g)=CH4(g)+2H2O(g)能自發進行,該反應的ΔH>0
B.堿性甲烷-空氣燃料電池的負極反應為CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
C.標準狀況下,5.6LCH4在空氣中完全燃燒,轉移電子的數目約為2.408×1024
D.甲烷和微生物共同作用可以實現城市廢水脫氮處理,反應溫度越高,脫氮速率越快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向7.5mL0.03molL-1的H3PO4溶液中,逐滴加入相同濃度的NaOH溶液,溶液pH與NaOH溶液體積關系如圖所示,已知Ka1>Ka2>Ka3,下列說法錯誤的是
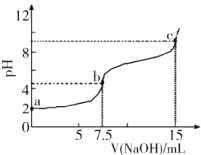
A.H3PO4第一級電離平衡常數Ka1的數量級為10-3
B.水的電離程度:b<c
C.b點溶液中離子濃度:c(Na+)>c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c點溶液中:2c(H3PO4)+c(![]() )+c(H+)=c(OH-)+c(
)+c(H+)=c(OH-)+c(![]() )
)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com