
分析 (1)①根據電子轉移數目守恒計算;
②根據v=$\frac{△c}{△t}$計算v(O2),再根據速率之比等于化學計量數之比計算v(H2O);
平衡常數指生成物濃度的系數次冪之積與反應物濃度系數次冪之積的比值;
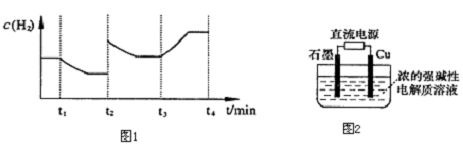
由圖可知H2的濃度隨時間降低,改變條件瞬間H2濃度不變,所以不可能是改變H2濃度,故改變的條件使平衡向逆反應移動;
由圖可知t2時,改變條件瞬間H2濃度增大,體積減小增大壓強可以使H2濃度增大,增大H2濃度也可使H2濃度增大;
t1時刻與t2時刻溫度相同,溫度不變,平衡常數不變.由圖可知t3時刻沒有加入或減少體系中的任何物質,H2濃度增大,平衡向正反應進行,該反應為氣體體積減小的反應,且正反應為吸熱反應,所以t3時刻改變的體積為升高溫度;
(2)根據蓋斯定律解答;
(3)銅在陽極上,被氧化,與氫氧根反應生成氧化亞銅與水.
解答 解:(1)①令生成的Cu2O的物質的量為nmol,根據電子轉移數目守恒,則有nmol×2×(1-0)=$\frac{3.36L}{22.4L/mol}$×2×[0-(-2)],解得n=0.3,所以可制備Cu2O的質量為0.3mol×144g/mol=43.2g,故答案為:43.2g;
②20min時O2的物質的量為0.0016mol,所以v(O2)=$\frac{\frac{0.0016mol}{2L}}{20min}$=4×10-5mol/(L•min),速率之比等于化學計量數之比,所以v(H2O)=2v(O2)=2×4×10-5mol/(L•min)=8×10-5mol/(L•min);
平衡常數指生成物濃度的系數次冪之積與反應物濃度系數次冪之積的比值,所以反應2H2O(g)?2H2(g)+O2(g)平衡常數的表達式k=$\frac{{c}^{2}({H}_{2})•c({O}_{2})}{{c}^{2}({H}_{2}O)}$;
由圖可知H2的濃度隨時間降低,改變條件瞬間H2濃度不變,所以不可能是改變H2濃度,故改變的條件使平衡向逆反應移動,使H2的濃度降低;
由圖可知t2時,改變條件瞬間H2濃度增大,體積減小增大壓強可以使H2濃度增大,增大H2濃度也可使H2濃度增大,所以改變的條件為增大壓強或增大H2濃度;
t1時刻與t2時刻溫度相同,溫度不變,平衡常數不變,所以K1=K2.t3時刻沒有加入或減少體系中的任何物質,由圖可知,H2濃度增大,所以平衡向正反應進行,該反應為氣體體積減小的反應,且正反應為吸熱反應,所以t3時刻改變的條件為升高溫度,所以K2<K3.所以K1=K2<K3;
故答案為:8×10-5mol/(L•min);$\frac{{c}^{2}({H}_{2})•c({O}_{2})}{{c}^{2}({H}_{2}O)}$;逆向;增大壓強或增大H2濃度;K1=K2<K3;
(2)已知:①2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
根據蓋斯定律,②-①得4CuO(s)+2C(s)=2CO(g)+2Cu2O(s),△H=+71kJ•mol-1
即2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.5kJ•mol-1
故答案為:2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.5kJ•mol-1;
(3)銅在陽極上,被氧化,與氫氧根反應生成氧化亞銅與水,電極反應式為2Cu++2OH--2e-=C2u+H2O.
故答案為:2Cu++2OH--2e-=C2u+H2O.
點評 本題總合性較大,涉及電子轉移守恒、反應速率、影響化學平衡的因素、熱化學方程式、電化學等.化學平衡的知識主要通過濃度-時間圖來進行,考查學生從圖象獲取信息的能力,難度較大.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的電負性隨原子序數增大而遞增的是④ | |
| B. | 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4對應的第一電離能最大的是④ | |
| C. | 某元素的逐級電離能分別為738、1451、7733、10540、13630、17995、21703,該元素在第三周期第 IIA族 | |
| D. | 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22 s22p63s23p4半徑最大的是① |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 酸 | 電離方程式 | 電離平衡常數K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,28gN2含有的原子數為2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-數為3NA | |
| C. | 標準情況下,2.24LCCl4含有的分子數NA | |
| D. | 常溫常壓下,22.4LCl2與足量鐵充分反應,轉移電子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 46g NO2和N2O4混合氣體中含有原子數為3NA | |
| B. | 標準狀況下22.4 L H2中含中子數為2NA | |
| C. | 1L 1mol/L醋酸溶液中離子總數為2NA | |
| D. | 1molFe與足量O2或Cl2反應均失去3NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1種 | B. | 2種 | C. | 3種 | D. | 4種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 $\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙
$\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙 (注明反應條件).
(注明反應條件). ).寫出同時符合①能發生銀鏡反應;②能與FeCl3溶液發生顯色反應;③核磁共振氫譜圖上產生4個吸收峰等要求的丙的同分異構體結構簡式
).寫出同時符合①能發生銀鏡反應;②能與FeCl3溶液發生顯色反應;③核磁共振氫譜圖上產生4個吸收峰等要求的丙的同分異構體結構簡式 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水制備金屬鈉 | B. | 加熱分解Ag2O制備金屬銀 | ||
| C. | Fe2O3與CO高溫下反應制備金屬鐵 | D. | Cu2S與O2高溫下反應制備金屬銅 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com